

L’industrie pharmaceutique est, dans le monde entier, un élément important des systèmes de santé. Elle comprend de nombreux services et entreprises, publics ou privés, qui découvrent, mettent au point, fabriquent et commercialisent des médicaments au service de la santé humaine et animale (Gennaro, 1990). L’industrie pharmaceutique repose principalement sur la recherche-développement (R-D) de médicaments destinés à prévenir ou à traiter des affections ou des troubles divers. Les différents médicaments ont une action pharmacologique et des propriétés toxicologiques très variables (Hardman et Limbird, 1996; Reynolds, 1989). Les progrès scientifiques et technologiques accélèrent la découverte et la mise au point de produits pharmaceutiques plus efficaces et aux effets secondaires réduits. Les spécialistes de biologie moléculaire et de chimie médicale et les pharmaciens améliorent les effets des préparations médicamenteuses en augmentant leur puissance et leur spécificité. Ces progrès suscitent néanmoins de nouvelles préoccupations pour la sécurité et la santé des travailleurs de l’industrie considérée (Agius, 1989; Naumann et coll., 1996; Sargent et Kirk, 1988; Teichman, Fallon et Brandt-Rauf, 1988).
L’industrie pharmaceutique subit l’influence de plusieurs facteurs dynamiques de nature scientifique, sociale ou économique. De nombreux groupes pharmaceutiques sont présents sur les marchés nationaux et multinationaux, de sorte que leurs activités et leurs produits sont soumis aux lois, aux règlements et aux politiques qui s’appliquent à la mise au point, à la fabrication, à l’autorisation, au contrôle de la qualité et à la commercialisation des médicaments dans de nombreux pays (Spilker, 1994). Les chercheurs — des institutions universitaires, de l’industrie et des services gouvernementaux —, les praticiens de la médecine et de la pharmacie ainsi que le grand public exercent tous, à des degrés divers, une influence sur l’industrie pharmaceutique. Les dispensateurs de soins (médecins, dentistes, infirmiers, pharmaciens et vétérinaires), qu’ils travaillent dans un hôpital, une clinique, une pharmacie ou un cabinet privé, peuvent prescrire des médicaments ou recommander comment les administrer. Les règlements officiels et la politique en matière de présentations pharmaceutiques sont également influencés par les consommateurs, des groupes de pression et des intérêts privés. Ces facteurs complexes sont interdépendants et jouent un rôle dans la découverte, la mise au point, la fabrication, la mise sur le marché et la vente des médicaments.
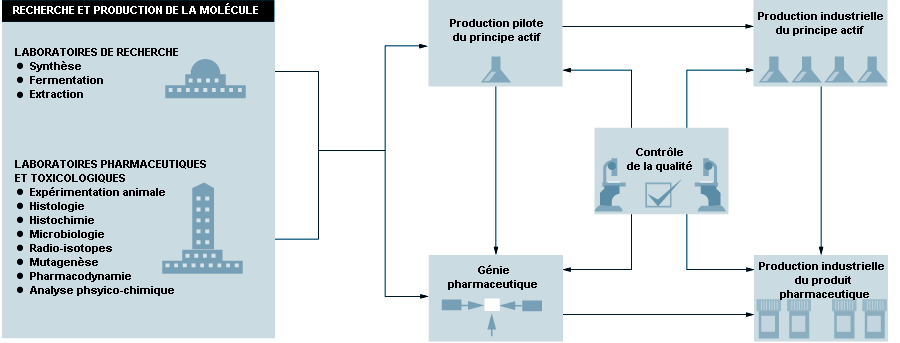
L’industrie pharmaceutique a pour moteur principal la R-D, à laquelle s’ajoutent les connaissances toxicologiques et l’expérience clinique (voir figure 79.1). Il y a des différences considérables entre les grands groupes qui se livrent à de multiples activités de R-D, de fabrication, de contrôle de la qualité et de commercialisation, et les firmes moins importantes qui se concentrent sur un aspect particulier. La plupart des sociétés pharmaceutiques multinationales mènent de front toutes ces activités, mais elles peuvent aussi se spécialiser dans un domaine particulier, en fonction des données du marché local. Les biotechnologies contribuent de plus en plus à l’innovation pharmaceutique (Swarbick et Boylan, 1996). Des accords de collaboration sont souvent conclus entre des centres de recherche ou des hôpitaux et de grands groupes pharmaceutiques pour explorer et tester le potentiel de médicaments nouveaux.
De nombreux pays appliquent aux spécialités pharmaceutiques et à leurs procédés de fabrication un système de protection juridique spécifique qui relève de la propriété intellectuelle. Lorsque cette protection est limitée ou fait défaut, certaines sociétés se spécialisent dans la fabrication et la commercialisation de médi-caments génériques (Medical Economics Co., 1995). L’industrie pharmaceutique doit consentir des investissements massifs en raison des dépenses élevées liées au secteur de la R-D, aux autorisations réglementaires, à la fabrication, à l’assurance et au contrôle de la qualité, à la commercialisation et à la vente (Spilker, 1994). Beaucoup de pays ont des règlements très détaillés régissant la mise au point et l’homologation des médicaments destinés à la vente et fixent des exigences rigoureuses pour les opérations de fabrication ainsi que pour la qualité, la sécurité et l’efficacité des produits (Gennaro, 1990).
Par ailleurs, le commerce national et international ainsi que les politiques et les pratiques fiscales et financières influent sur le fonctionnement de l’industrie pharmaceutique à l’intérieur d’un pays (Swarbick et Boylan, 1996). Les besoins en produits pharmaceutiques sont très différents d’un pays à l’autre. Dans les pays en développement, où prédominent la malnutrition et les maladies infectieuses, les produits les plus nécessaires sont les compléments nutritionnels, les vitamines et les anti-infectieux. Dans les pays développés, où les principaux problèmes de santé sont les maladies liées au vieillissement ainsi que certaines affections spécifiques, ce sont les produits agissant sur le système cardio-vasculaire, le système nerveux central ou l’appareil digestif, ainsi que les anti-infectieux, les antidiabétiques et les anticancéreux qui sont le plus demandés.
Les médicaments, qu’ils soient destinés à l’humain ou à l’animal, donnent lieu à des activités de R-D et à des procédés de fabrication similaires, même s’ils ont des avantages thérapeutiques et des mécanismes d’homologation, de distribution et de commercialisation spécifiques (Swarbick et Boylan, 1996). Les vétérinaires administrent couramment des vaccins, des anti-infectieux et des antiparasitaires pour lutter contre les maladies infectieuses et parasitaires des animaux d’élevage et des animaux de compagnie. L’agriculture moderne fait largement appel aux compléments nutritionnels, aux antibiotiques et aux hormones pour améliorer la croissance et la santé des animaux d’élevage. Les activités de R-D consacrées aux médicaments à usage humain ou vétérinaire sont souvent apparentées, la nécessité de lutter contre les agents infectieux et les maladies qu’ils provoquent étant la même dans les deux secteurs.
|
Les termes ci-après sont fréquemment employés dans l’industrie pharmaceutique: Agents biologiques: vaccins d’origine bactérienne ou virale, antigènes, antitoxines et produits analogues, sérums, plasmas et autres dérivés sanguins utilisés à des fins préventives ou curatives chez l’humain et chez l’animal. Agents diagnostiques: produits utilisés pour aider à dépister les maladies et les troubles chez l’humain ou chez l’animal. Il peut s’agir de produits chimiques inorganiques destinés à étudier le tractus digestif, de produits chimiques organiques permettant de visualiser l’appareil circulatoire ou le foie, ou encore de composés radioactifs pour étudier le fonctionnement d’un système organique. Excipients: constituants inertes incorporés à des substances médicamenteuses dans une présentation pharmaceutique. Les excipients peuvent influer sur la vitesse d’absorption, la dissolution, la libération, le métabolisme et la distribution chez l’humain ou chez l’animal. Médicaments: substances possédant des propriétés pharmacologiques actives chez l’humain et chez l’animal. Les médicaments sont associés à d’autres produits, tels que des excipients, pour donner des produits à usage médicamenteux. Médicaments sur ordonnance: agents biologiques ou chimiques destinés à prévenir, diagnostiquer ou traiter des maladies ou des troubles chez l’humain et chez l’animal, délivrés sur ordonnance ou avec l’autorisation d’un médecin, d’un pharmacien ou d’un vétérinaire. Pharmacie: art et science de la préparation, du contrôle et de la délivrance des médicaments destinés à prévenir, diagnostiquer ou traiter des maladies ou des troubles chez l’humain et chez l’animal. Pharmacocinétique: étude du devenir des médicaments dans l’organisme, c’est-à-dire des processus métaboliques liés à l’absorption, la distribution, la biotransformation et l’élimination d’un médicament chez l’humain et chez l’animal. Pharmacodynamie: étude de l’action exercée par les médicaments sur l’organisme sain, en fonction de leur structure chimique et de leur lieu d’action, et analyse de leurs répercussions biochimiques et physiologiques chez l’humain et chez l’animal. Présentations pharmaceutiques en vente libre: produits médicamenteux vendus dans une pharmacie ou dans un magasin et dont la délivrance ne nécessite ni ordonnance ni autorisation d’un médecin, d’un pharmacien ou d’un vétérinaire. Principes actifs: substances ayant un pouvoir thérapeutique. Produits chimiques de base: principes actifs utilisés pour fabriquer des produits sous forme pharmaceutique (galénique), des aliments pour animaux ayant des propriétés thérapeutiques, ou encore des médicaments ne pouvant être délivrés que sur ordonnance. |
L’industrie pharmaceutique découvre, met au point et utilise de nombreux agents biologiques et chimiques (Hardman et Limbird, 1996; Reynolds, 1989). Si certains de ses procédés de fabrication sont analogues à ceux de la biochimie et de la chimie organique de synthèse, ils s’en distinguent cependant par leur plus grande diversité, leur échelle plus réduite et la spécificité de leurs applications. Etant donné que l’objectif principal est la production de substances médicinales ayant une activité pharmacologique, de nombreux produits utilisés par l’industrie pharmaceutique dans le secteur de la R-D et dans la production comportent des risques pour les opérateurs. Il convient donc de prendre des mesures efficaces pour assurer leur protection contre les produits chimiques et les substances médicamenteuses utilisés dans de nombreuses opérations dans les secteurs de la R-D, de la fabrication et du contrôle de la qualité (Bureau international du Travail (BIT), 1983; Naumann et coll., 1996; Teichman, Fallon et Brandt-Rauf, 1988).
L’industrie pharmaceutique utilise des agents biologiques (com-me les bactéries et les virus) dans de nombreuses applications spéciales, telles que la production de vaccins, les processus de fermentation, la préparation de dérivés sanguins et la biotechnologie. Du fait de leurs applications particulières, les agents biologiques ne sont pas traités ici, mais de nombreuses études leur ont été consacrées (Swarbick et Boylan, 1996). Les agents chimiques, quant à eux, peuvent être classés en deux catégories: les produits chimiques industriels et les substances médicamenteuses (Gennaro, 1990); il peut s’agir de matières premières, de produits intermédiaires ou de produits finis. L’utilisation de produits chimiques industriels ou de substances médicamenteuses en R-D, en laboratoire, dans les essais d’assurance et de contrôle de la qualité ou dans les activités d’ingénierie et de maintenance crée des situations particulières. Il en va de même lorsque ces produits ou substances sont des sous-produits ou des déchets.
Les produits chimiques industriels sont utilisés dans le secteur de la R-D pour la mise au point de substances actives et la fabrication de matières de base et de produits pharmaceutiques finis. Les produits organiques et minéraux peuvent être des matières premières utilisées comme réactifs, catalyseurs ou solvants. L’utilisation des produits chimiques industriels dépend du procédé mis en œuvre et des opérations de fabrication. Nombre de ces produits peuvent présenter des dangers pour les opérateurs, ce qui a conduit les gouvernements et les organismes gouvernementaux techniques ou professionnels (American Conference of Governmental Industrial Hygienists (ACGIH), 1995) à fixer des limites d’exposition professionnelle, telles que les valeurs seuils.
Les substances pharmacologiquement actives peuvent être subdivisées en produits naturels et en médicaments de synthèse. Les produits naturels sont d’origine végétale ou animale, alors que les médicaments de synthèse sont obtenus par des techniques microbiologiques et chimiques. Les antibiotiques, les hormones stéroïdes et peptidiques, les vitamines, les enzymes, les prostaglandines et les phéromones sont des produits naturels importants. La recherche s’intéresse de plus en plus aux médicaments de synthèse, compte tenu des progrès récents de la biologie moléculaire, de la biochimie, de la pharmacologie et de l’informatique. Le tableau 79.1 donne une liste des principales catégories de substances pharmaceutiques.
|
Système nerveux central |
Reins et appareil cardio-vasculaire |
Appareil digestif |
Anti-infectieux et organes cibles |
Système immunitaire |
Chimiothérapie |
Sang et organes hématopoïétiques |
Système endocrinien |
|
Analgésiques Paracétamol Salicylés Anesthésiques Généraux et locaux Anticonvulsivants Barbituriques Benzodiazépines Antimigraineux β-bloquants Antisérotoniner- giques Stupéfiants Opiacés Produits utilisés en psychiatrie Anxiolytiques Antidépresseurs Sédatifs et hypnotiques Barbituriques Benzodiazépines |
Antidiabétiques Biguanides Inhibiteurs de la glycosidase Insulines Sulfonylurées Cardioprotecteurs β-bloquants Tonicardiaques Inhibiteurs de l’angiotensine Antiarythmiques Inhibiteurs calciques Diurétiques Vasodilatateurs Vasodépresseurs |
Produits utilisés Antiacides Antiflatulents Antidiarrhéiques Antiémétisants Antispasmodiques Laxatifs Prostaglandines |
Anti-infectieux systémiques Traitements du sida Amœbicides Antihelminthiques Antibiotiques Antifongiques Antipaludéens Sulfamides Céphalosporines, pénicillines tétracyclines, etc. Produits utilisés en pneumologie Antitussifs Bronchodilatateurs Décongestionnants Expectorants Produits utilisés en dermatologie Antiacnéiques Allergènes Antibiotiques Anti-infectieux Cicatrisants Emollients Produits utilisés en urologie Anti-infectieux Antispasmodiques Produits utilisés en gynécologie Antifongiques |
Analgésiques Anti-inflammatoires non stéroïdiens Modificateurs de la réponse biologique Inhibiteurs de l’alphaprotéase Antitoxines Sérums immunisants Toxoïdes Vaccins Antifibrosiques Immuno-modulateurs et immuno-suppresseurs Traitement de la sclérose en plaques |
Antinéoplasiques Traitements d’appoint Agents alkylants Antibiotiques Antimétabolites Hormones Immunomodulateurs |
Produits utilisés en hématologie Anticoagulants Antiagrégants plaquettaires Facteurs stimulant les colonies Antianémiques Hémostatiques Fractions plasmatiques Vasodilatateurs Vasodilatateurs cérébraux |
Agents diagnostiques Corticoïdes Glucocorticoïdes Gonadostimulines Dysfonctionnement de l’hypothalamus Tests de la fonction thyroïdienne Hormones Inhibiteurs des corticoïdes Stéroïdes anabolisants Androgènes Œstrogènes Gonadotrophines Hormone de croissance Progestérone Somatostatine Prostaglandines |
La pharmacie galénique associe des principes actifs à des matières inertes pour produire des médicaments sous la forme désirée (comprimés, capsules, gélules, solutions, suspensions, émulsions, granulés, poudres, crèmes, pommades, etc.) (Gennaro, 1990). Les médicaments peuvent être classés d’après leur procédé de fabrication et leurs avantages thérapeutiques (Environmental Protection Agency (EPA), 1995). Ils sont administrés aux patients selon des modalités (voie orale, parentérale, percutanée, etc.) et des posologies strictement définies, mais les travailleurs de l’industrie pharmaceutique peuvent également y être exposés en inhalant accidentellement des particules ou des vapeurs ou en ingérant des boissons ou des aliments contaminés. C’est pourquoi les toxicologues et les hygiénistes industriels ont défini des limites d’exposition professionnelle aux produits chimiques (Naumann et coll., 1996; Sargent et Kirk, 1988).
Des adjuvants ou excipients pharmaceutiques (liants, supports, aromatisants, diluants, conservateurs, antioxydants) sont mélangés aux principes actifs pour conférer au produit les propriétés physiques et pharmacologiques désirées (Gennaro, 1990). De nombreux excipients ont un effet thérapeutique nul ou limité et sont relativement inoffensifs pour les travailleurs au cours des opérations de mise au point et de fabrication. Il s’agit des antioxydants, des agents conservateurs, colorants et aromatisants, des diluants, des agents émulsifiants et de suspension, des vecteurs d’onguents et des solvants pharmaceutiques.
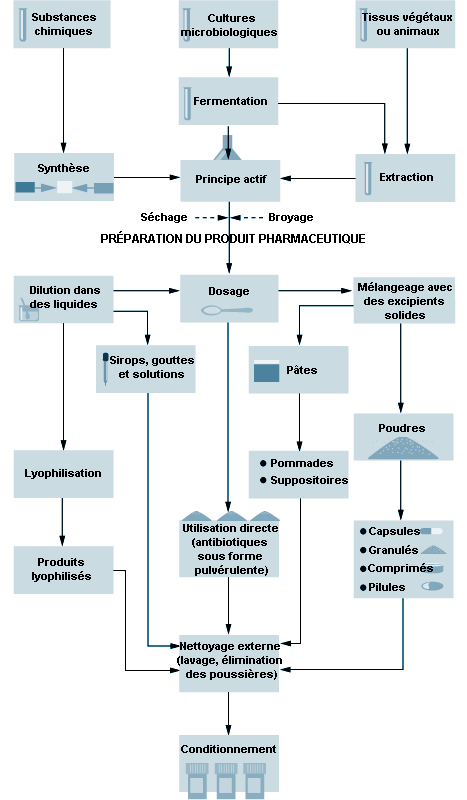
Les opérations de fabrication pharmaceutique se subdivisent en production des principes actifs et en mise en forme pharmaceutique. La figure 79.2 représente schématiquement le processus de fabrication.
La production des principes actifs fait appel à trois grands types de procédés: la fermentation , la synthèse chimique organique et l’extraction biologique et naturelle (Theodore et McGuinn, 1992). Ces procédés peuvent s’effectuer par lots ou en continu, ou en mode mixte. Les antibiotiques, les stéroïdes et les vitamines sont obtenus par fermentation, alors que de nombreux médicaments nouveaux sont préparés par synthèse organique. Dans le passé, la plupart des médicaments étaient issus de sources naturelles (plantes, animaux, champignons et autres organismes). Les médicaments naturels sont pharmacologiquement très divers et difficiles à produire à l’échelle industrielle, en raison de leur composition chimique complexe et de leur activité limitée.
La fermentation est un processus biochimique utilisant des micro-organismes sélectionnés et des techniques microbiologiques pour obtenir un produit chimique. Les procédés de fermentation par lots comportent trois étapes principales: la préparation de l’inoculum (produit introduit par inoculation) et de l’ensemencement, la fermentation et la récupération ou l’isolement du produit (Theodore et McGuinn, 1992). La figure 79.3 représente schématiquement un procédé de fermentation. La préparation de l’inoculum part d’un échantillon de spore provenant d’une souche microbienne. Cette souche est cultivée sélectivement, purifiée et multipliée au moyen de techniques microbiologiques pour obtenir le produit désiré. Les spores sont activées en présence d’eau, d’éléments nutritifs et de chaleur. Les cellules issues de la culture sont multipliées par passage en série sur des plaques de gélose, dans des tubes à essai et des flacons, et cela dans des conditions d’environnement bien définies, afin d’obtenir une suspension dense.
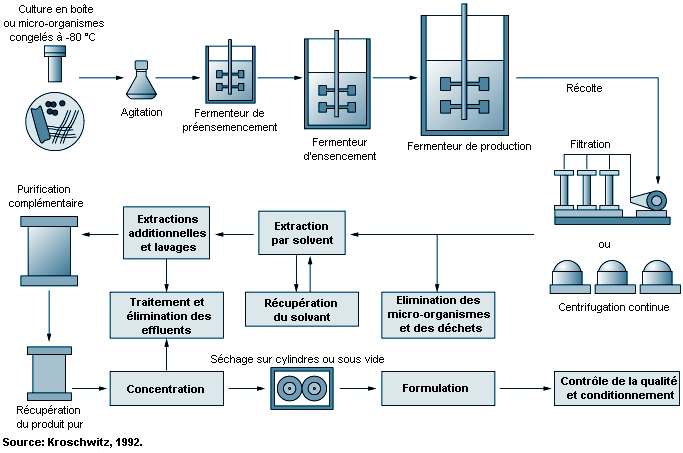
Les cellules sont alors placées dans une cuve d’ensemencement , qui est une petite cuve de fermentation destinée à optimiser la croissance de l’inoculum. Les cellules provenant de cette cuve sont ensuite transférées dans un fermenteur stérilisé à la vapeur, où l’on ajoute des éléments nutritifs stérilisés et de l’eau purifiée pour déclencher le processus. Au cours de la fermentation aérobie, le contenu du fermenteur est chauffé, agité et aéré à l’aide d’un tube perforé ou aérateur permettant de maintenir une température et un débit d’air optimaux. Une fois les réactions biochimiques terminées, on filtre le bouillon de fermentation pour extraire les micro-organismes ou mycélium . La substance médicamenteuse présente dans le filtrat ou dans le mycélium est récupérée par des procédés tels que l’extraction par solvant, la précipitation, l’échange d’ions ou l’absorption.
Les solvants d’extraction (voir tableau 79.2) peuvent généralement être récupérés. Selon leur solubilité et selon la conception du matériel, il en reste toutefois de petites quantités dans l’eau résiduelle. On sépare la substance médicamenteuse du bouillon aqueux par précipitation, en le filtrant et en l’extrayant des résidus solides. On utilise souvent, dans ce procédé, le cuivre et le zinc comme agents précipitants. L’échange d’ions (ou adsorption) sépare la substance du bouillon par réaction chimique avec des matières solides telles que des résines ou du charbon activé. La substance est extraite de la phase solide par un solvant qui peut être récupéré par évaporation.
|
Solvants |
Procédés |
||
|
Acétate d’éthyle |
C |
F |
B |
|
Acétate d’isopropyle |
C |
F |
B |
|
Acétate de n-amyle |
C |
F |
B |
|
Acétate de n-butyle |
C |
F |
|
|
Acétone |
C |
F |
B |
|
Acétonitrile |
C |
F |
B |
|
Alcool amylique |
C |
F |
B |
|
Alcool n-butylique |
C |
F |
B |
|
Ammoniaque |
C |
F |
B |
|
Aniline |
C |
||
|
Benzène |
C |
||
|
2-Butanone |
C |
||
|
Chlorobenzène |
C |
||
|
Chloroforme |
C |
F |
B |
|
Chlorométhane |
C |
||
|
Chlorure de méthylène |
C |
F |
B |
|
Cyclohexane |
C |
||
|
o-Dichlorobenzène (1,2-dichlorobenzène) |
C |
||
|
1,2-Dichloroéthane |
C |
B |
|
|
Diéthylamine |
C |
B |
|
|
N,N-Diméthylacétamide |
C |
||
|
Diméthylamine |
C |
||
|
N,N-Diméthylaniline |
C |
||
|
N,N-Diméthylformamide |
C |
F |
B |
|
Diméthylsulfoxyde |
C |
B |
|
|
1,4-Dioxane |
C |
B |
|
|
Ethanol |
C |
F |
B |
|
Solvants |
Procédés |
||
|
Ether diéthylique |
C |
B |
|
|
Ether isopropylique |
C |
B |
|
|
Ethylèneglycol |
C |
B |
|
|
Formaldéhyde |
C |
F |
B |
|
Formamide |
C |
||
|
Formiate de méthyle |
C |
||
|
Furfural |
C |
||
|
n- Heptane |
C |
F |
B |
|
n-Hexane |
C |
F |
B |
|
Isobutyraldéhyde |
C |
||
|
Isopropanol |
C |
F |
B |
|
Méthanol |
C |
F |
B |
|
Méthyl cellosolve |
C |
F |
|
|
Méthylamine |
C |
||
|
Méthylisobutylcétone |
C |
F |
B |
|
2-Méthylpyridine |
C |
||
|
Naphta de pétrole |
C |
F |
B |
|
Phénol |
C |
F |
B |
|
Polyéthylèneglycol 600 |
C |
||
|
n-Propanol |
C |
B |
|
|
Pyridine |
C |
B |
|
|
Tétrahydrofurane |
C |
||
|
Toluène |
C |
F |
B |
|
Trichlorofluorométhane |
C |
||
|
Triéthylamine |
C |
F |
|
|
Xylènes |
C |
||
C = synthèse chimique; F = fermentation; B = extraction naturelle ou biologique.
Source: Environmental Protection Agency (EPA), 1995.
Les machines et les engins en mouvement; la vapeur sous haute pression, l’eau chaude, des surfaces brûlantes et la chaleur ambiante; des produits chimiques corrosifs et irritants; la manutention de matériaux et d’engins lourds; et un niveau de bruit élevé sont de nature à menacer la sécurité des travailleurs. Ceux-ci peuvent être exposés à des vapeurs de solvants lorsqu’ils récupèrent ou isolent des produits, par suite du non-confinement de matériels de filtration ou de fuites au niveau des pompes, des vannes ou des collecteurs lors des étapes d’extraction et de purification. Etant donné que l’isolement et la croissance des micro-organismes sont essentiels à la fermentation, on réduit les risques biologiques en utilisant des micro-organismes non pathogènes et du matériel étanche et en traitant le bouillon de culture utilisé avant de l’éliminer.
En général, les questions de sécurité sont moins importantes lors de la fermentation que lors des opérations de synthèse organique, parce que la fermentation repose principalement sur une chimie en milieu aqueux et qu’elle suppose un confinement pendant la préparation de l’ensemencement et la fermentation. Il peut y avoir des risques d’incendie et d’explosion lors de l’extraction par solvant, mais les risques d’inflammation sont réduits par dilution dans l’eau au cours des étapes de filtration et de récupération. Les masses de vapeur sous pression et d’eau chaude nécessaires présentent évidemment des risques de brûlure et d’ébouillantage.
Les procédés de synthèse chimique organique font appel à des produits chimiques organiques et minéraux lors d’opérations par lots destinées à produire des médicaments ayant des propriétés physiques et pharmacologiques spécifiques. En général, une série de réactions chimiques a lieu dans des réacteurs polyvalents, et les produits sont isolés par extraction, cristallisation et filtration (Kroschwitz, 1992). Les produits finis sont généralement séchés, broyés et mélangés. Les usines de synthèse organique, le matériel et les équipements employés dans l’industrie pharmaceutique sont comparables à ceux de la chimie fine. La figure 79.4 représente schématiquement un processus de synthèse organique.
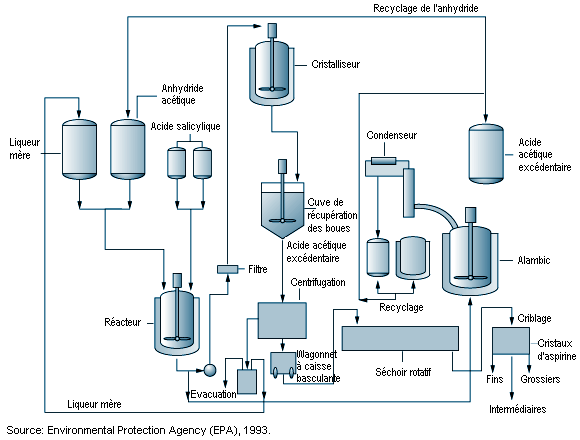
La chimie pharmaceutique revêt une complexité croissante et comporte des opérations en plusieurs étapes; le produit issu d’une étape devient la matière première de l’étape suivante, et cela jusqu’à la synthèse du produit fini. Les produits chimiques de base, qui sont des produits intermédiaires, peuvent, pour des raisons techniques, financières et juridiques, être transférés d’une usine de synthèse organique à l’autre. La plupart des produits intermédiaires et des autres produits indispensables sont fabriqués lors d’une série de réactions par lots, organisées selon des campagnes de fabrication. Les opérations s’effectuent de façon intermittente, les installations étant modifiées en fonction des besoins de chaque procédé. Etant donné la diversité et la complexité de la chimie moderne des médicaments, les usines de synthèse organique sont souvent conçues pour une souplesse d’exploitation maximale.
Les réacteurs multivalents constituent l’équipement de base pour les opérations de synthèse chimique (voir figure 79.5). Ce sont des cuves sous pression renforcées, garnies intérieurement d’acier inoxydable, de verre ou d’un alliage métallique. La nature des réactions chimiques et les propriétés physiques des matériaux (réactifs, corrosifs, inflammables) déterminent leur conception, leurs caractéristiques et leur construction. Les réacteurs multivalents ont une double paroi et des serpentins où circulent de l’eau de refroidissement, de la vapeur ou des fluides frigoporteurs. La cuve du réacteur est chauffée ou refroidie selon les cas. Un réacteur multivalent est équipé d’agitateurs, de chicanes et de plusieurs orifices d’entrée et de sortie qui permettent de le connecter à d’autres cuves ou appareils et de l’alimenter en matières premières. Des instruments de mesure de la température, de la pression et du poids contrôlent les processus chimiques au sein du réacteur. Selon sa conception et ses caractéristiques et selon les nécessités du processus chimique, un réacteur peut fonctionner sous pression élevée ou sous un vide peu poussé.
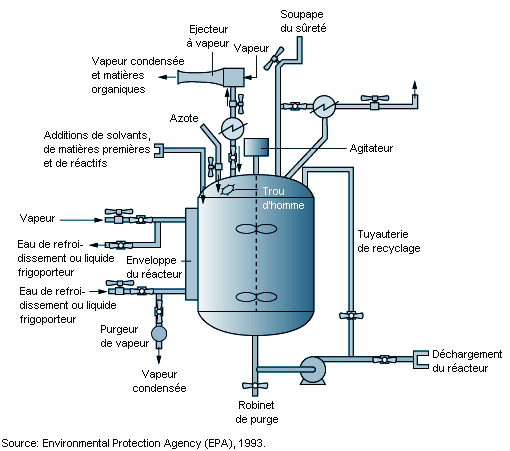
Des échangeurs de chaleur sont reliés aux réacteurs pour réchauffer ou refroidir le milieu réactionnel et condenser les vapeurs des solvants chauffés au-dessus de leur point d’ébullition, ce qui entraîne un reflux ou un recyclage des vapeurs condensées. Des dispositifs antipollution (épurateurs et impacteurs) peuvent être connectés aux soupapes d’échappement des cuves pour réduire les émissions de gaz, de vapeurs et de particules (EPA, 1993). Des solvants volatils et des produits chimiques toxiques risquent de s’échapper dans les ateliers ou dans l’atmosphère s’ils ne sont pas récupérés pendant la réaction par des échangeurs de chaleur ou des dispositifs antipollution. Certains solvants (comme le chlorure de méthylène et le chloroforme) (voir tableau 79.2) et certains réactifs sont difficiles à condenser, absorber ou adsorber à l’aide de dispositifs antipollution en raison de leurs propriétés chimiques et physiques.
Les produits chimiques de base sont récupérés ou isolés par séparation, purification ou filtration. Généralement, ces produits sont contenus dans des liqueurs mères , sous forme de solides dissous ou en suspension dans un mélange de solvants. Les liqueurs mères peuvent être transférées d’une cuve ou d’une installation à l’autre par des canalisations temporaires ou à demeure à l’aide de pompes, de gaz inerte sous pression, du vide ou de la pesanteur. Les transferts sont délicats en raison des vitesses de réaction, des températures ou des pressions critiques, des caractéristiques des installations et du risque de fuites ou de déversement accidentel. Des précautions spéciales seront prises pour combattre l’électricité statique lorsqu’un procédé met en œuvre ou libère des gaz, des vapeurs ou des liquides inflammables. Le transfert de liquides inflammables à l’aide de tubes plongeurs immergés, la mise à la terre et le maintien d’une atmosphère inerte à l’intérieur des appareils sont des mesures propres à réduire les risques d’incendie et d’explosion (Crowl et Louvar, 1990).
Les opérations de synthèse comportent de nombreux risques pour la sécurité et la santé des travailleurs. Pour ce qui est des risques d’accident, citons: les pièces mécaniques en mouvement; les installations sous pression; la manutention de matériaux et d’engins pesants; la vapeur, les liquides chauds, les surfaces brûlantes et la chaleur ambiante; les espaces confinés, les sources d’énergie dangereuses (par exemple, électricité); et des niveaux de bruit élevés.
Quant à la santé, des risques d’intoxication aiguë ou chronique peuvent résulter de l’exposition à des produits chimiques dangereux. Les produits comportant un risque d’intoxication aiguë peuvent provoquer des lésions oculaires ou cutanées, avoir un effet corrosif ou irritant sur les tissus de l’organisme, entraîner une sensibilisation ou des réactions allergiques ou être asphyxiants et provoquer une suffocation ou un manque d’oxygène. Les produits comportant un risque d’intoxication chronique peuvent être à l’origine de cancers ou de lésions hépatiques, rénales ou pulmonaires, ou agir sur le système nerveux ou le système endocrinien, l’appareil génital ou d’autres systèmes organiques. Il est possible de limiter les risques pour la sécurité et la santé par des moyens appropriés (modification des procédés, prévention technique, mesures administratives, équipements de protection individuelle, etc.).
Les réactions de synthèse organique peuvent comporter des risques d’accidents majeurs du fait de la présence de produits très dangereux. Des incendies, des explosions ou des réactions chimiques incontrôlées sont susceptibles d’avoir de graves répercussions sur les populations du voisinage et l’environnement. Les mesures à prendre pour assurer la sécurité peuvent être extrêmement complexes: il faut tenir compte de la dynamique des réactions chimiques, des propriétés des matières très dangereuses, de la conception, du fonctionnement et de la maintenance des installations, de la formation du personnel, de la préparation de plans d’urgence et des réactions des personnes présentes sur le site et de la population. L’analyse et la gestion des risques liés aux opérations de synthèse chimique ont fait l’objet de nombreuses études (Crowl et Louvar, 1990; Kroschwitz, 1992).
De nombreuses matières naturelles, comme celles d’origine végétale ou animale, peuvent fournir des substances pharmacologi-quement actives (Gennaro, 1990; Swarbick et Boylan, 1996). A chaque étape successive de leur traitement, ces matières sont réduites par une série d’opérations par lots qui durent en général quelques semaines, et cela jusqu’à l’obtention de la quantité voulue de produit final. Des solvants sont utilisés pour éliminer les graisses et les huiles insolubles, ce qui permet d’isoler le produit final. Le pH (acidité) de la solution d’extraction et des déchets peut être modifié en les neutralisant avec des bases ou des acides forts. Des composés métalliques sont fréquemment utilisés comme agents de précipitation, et des composés phénolés comme désinfectants.
Le contact avec certaines plantes peut provoquer des réactions allergiques ou des irritations cutanées. Faute de précautions appropriées, les matières d’origine animale peuvent être contaminées par des agents infectieux. Pendant les opérations d’extraction, le personnel peut être exposé à des solvants et à des produits chimiques corrosifs. Le stockage, la manipulation, le traitement et la récupération des liquides inflammables comportent des risques d’incendie et d’explosion. Les pièces mécaniques en mouvement, la vapeur, l’eau chaude, les surfaces brûlantes, la chaleur ambiante et des niveaux de bruit élevés peuvent présenter des risques pour les opérateurs.
Les problèmes de sécurité liés au procédé sont souvent atténués du fait des quantités importantes de matières d’origine végétale ou animale et de l’ampleur limitée des activités d’extraction par solvant.
Les principes actifs sont transformés en médicaments avant d’être distribués ou administrés à l’humain ou à l’animal. Ils sont mélangés à des adjuvants appropriés: liants, supports, aromatisants, diluants, conservateurs, colorants, antioxydants, etc. Les constituants des présentations pharmaceutiques sont séchés, broyés, mélangés, comprimés ou granulés en vue d’obtenir la forme désirée. Les comprimés et les gélules sont des formes très courantes pour l’administration par voie orale, de même que les liquides stériles pour l’administration parentérale ou l’usage ophtalmique. La figure 79.8 illustre les opérations essentielles de préparation des formes pharmaceutiques.
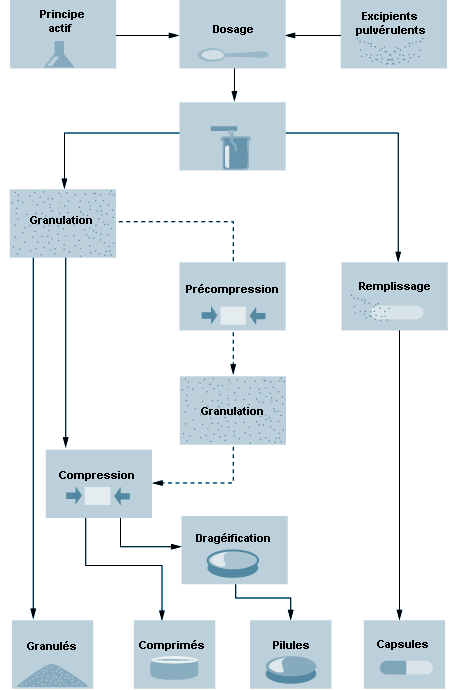
Les mélanges pharmaceutiques peuvent être comprimés par granulation par voie humide, par compression directe ou par briquetage afin d’obtenir les propriétés physiques désirées avant d’être mis sous leur forme finale. Dans la granulation par voie humide , les ingrédients actifs et les excipients sont mouillés avec une solution aqueuse ou contenant des solvants pour donner des granulés grossiers à particules de grand calibre. Ces granulés sont séchés, mélangés à des lubrifiants (stéarate de magnésium), des désintégrants ou liants, puis transformés en comprimés par compression. Dans la compression directe , un poinçon comprime la quantité voulue de mélange contenu dans une matrice de métal. Les produits qui ne sont pas assez stables pour subir une granulation par voie humide ou une compression directe font l’objet d’un briquetage ou granulation par voie sèche . Ce procédé consiste à mélanger les constituants et à produire des comprimés relativement gros qui sont ensuite broyés et tamisés pour obtenir le calibre voulu. Le granulé obtenu est soumis à une dernière compression pour donner le comprimé final. Les substances mélangées et granulées peuvent également être préparées sous forme de gélules. Les capsules de gélatine dure sont séchées, ébarbées, remplies et formées dans des remplisseuses.
Les liquides peuvent être des solutions stériles injectables, des collyres, des solutés, des suspensions ou des sirops, ou encore des teintures à appliquer sur la peau (Gennaro, 1990). La préparation des liquides stériles requiert des conditions ambiantes bien définies, un équipement isolé et des matières premières très pures afin d’éviter la contamination microbienne et particulaire (Cole, 1990; Swarbick et Boylan, 1996). Les installations et les surfaces de travail doivent être nettoyées avec soin pour prévenir et limiter la contamination le plus possible. L’utilisation d’eau à température et sous pression élevées permet de détruire et de filtrer les bactéries et autres contaminants de l’eau stérile utilisée entrant dans la préparation de solutés injectables. Les liquides destinés à l’administration parentérale (voie sous-cutanée, intramusculaire ou intraveineuse) sont stérilisés à la chaleur sèche ou humide sous haute pression et filtrés pour retenir les bactéries. Les solutions à usage oral ou topique ne nécessitent pas de stérilisation, au contraire des collyres. On prépare les liquides buvables en mélangeant les matières actives avec un solvant ou un conservateur afin d’inhiber la croissance des moisissures et des bactéries. Les suspensions et les émulsions sont produites respectivement à l’aide de broyeurs colloïdaux et d’homogénéisateurs. Les crèmes et les onguents sont préparés par mélangeage ou incorporation des principes actifs à de la vaseline, des graisses lourdes ou des émollients, avant d’être conditionnés dans des tubes de métal ou de matière plastique.
Au cours de la préparation des produits pharmaceutiques, les risques pour la sécurité et la santé des travailleurs sont liés aux pièces mécaniques en mouvement (engrenages, courroies, arbres non protégés) et à la présence de sources d’énergie dangereuses (électrique, pneumatique, thermique, etc.); à la manutention de matériaux et d’engins lourds; à la vapeur sous haute pression, à l’eau chaude et aux surfaces brûlantes, à des liquides inflammables ou corrosifs; et au niveau de bruit élevé. Les opérateurs peuvent être exposés à des particules en suspension dans l’air au cours des opérations de répartition, de séchage, de broyage et de mélangeage. L’exposition aux produits pharmaceutiques pose surtout un problème lors de la manipulation ou du traitement de mélanges contenant des proportions élevées de principes actifs. Les opérations de granulation par voie humide, de mélangeage et d’enrobage peuvent exposer les opérateurs à de fortes concentrations de vapeurs de solvants.
Au cours des opérations de mise en forme pharmaceutique, les principaux problèmes de sécurité sont liés aux risques d’incendie et d’explosion. Beaucoup de ces opérations (granulation, homogénéisation, composition et séchage) font appel à des liquides inflammables qui peuvent créer des atmosphères inflammables ou explosives. Il convient d’étudier les propriétés physiques de ces substances avant de les utiliser. Le séchage sur lit fluidisé, le broyage et la granulation par voie sèche sont des opérations particulièrement délicates lorsqu’il y a des substances potentiellement explosives. La mise en œuvre d’une présentation technique appropriée et des méthodes de travail sûres permettront de réduire les risques liés aux particules explosives et aux liquides inflammables (matériel électrique et installations étanches aux vapeurs et aux poussières, mise à la terre des appareils, conteneurs étanches avec limiteurs de pression et atmosphère inerte, etc.).
Dans toutes les opérations pharmaceutiques, les mesures ci-après sont applicables: prévention des incendies et des explosions; isolement des procédés mettant en œuvre des substances dangereuses, protection contre les risques mécaniques et les niveaux de bruit élevés; ventilation par dilution et par aspiration localisée; port d’appareils de protection respiratoire (masques antipoussières, masques filtrants contre les vapeurs organiques et, dans certains cas, appareils autonomes à adduction d’air filtré ou masques et combinaisons à alimentation d’air) et d’équipements de protection individuelle; et formation du personnel. En cas de difficultés particulières, il faut s’efforcer d’utiliser des matières moins dangereuses. La stricte limitation des transferts de matières, des activités de traitement et d’échantillonnage à l’air libre ou dans des systèmes ouverts ou non étanches réduit également les risques d’exposition.
La conception et les caractéristiques techniques des locaux, des installations et des moyens mis en œuvre peuvent éviter la pollution de l’environnement et réduire l’exposition des travailleurs aux substances dangereuses. Les installations modernes limitent les risques pour l’environnement, la sécurité et la santé en prévenant la pollution et en améliorant la maîtrise des risques. L’amélioration de l’isolement, du confinement et de la propreté des ateliers de fabrication et des installations de production permet d’atteindre les objectifs fixés en matière de sécurité et de protection de la santé du personnel ainsi que de contrôle de la qualité. La prévention de l’exposition aux substances et aux produits pharmaceutiques dangereux est parfaitement compatible avec la nécessité d’empêcher les travailleurs de contaminer accidentellement les matières premières et les produits finis. Méthodes de travail sûres et procédés de fabrication éprouvés sont complémentaires.
La conception et les caractéristiques techniques des installations et de l’équipement de l’industrie pharmaceutique ont une incidence évidente sur la sécurité et la santé du personnel. Le choix des matériaux de construction et des matériels ainsi que le soin apporté à la maintenance ont une influence considérable sur la propreté des ateliers de production. Les systèmes de ventilation par dilution et par aspiration localisée permettent de maîtriser les fuites de vapeurs et de particules. En présence de liquides ou de vapeurs inflammables, il faut prendre les mesures qui s’imposent (matériels et installations électriques étanches aux vapeurs et aux poussières, extincteurs, détecteurs d’incendie et de fumée, systèmes d’alarme). Des installations de stockage et de transport (cuves de stockage, conteneurs portables, pompes et canalisations) permettent d’acheminer les liquides à l’intérieur de l’usine. Les solides dangereux peuvent être stockés et traités dans des cuves isolées, des conteneurs de vrac individuels ou des fûts ou des sacs scellés. L’isolement ou le confinement des locaux, des installations de production et des produits dangereux contribuent à la sécurité et à la protection de la santé du personnel. Les risques mécaniques sont réduits par l’installation de protecteurs sur les pièces en mouvement.
Les machines et les utilités peuvent être commandées par voie manuelle ou automatique. Dans les systèmes manuels, ce sont des opérateurs qui surveillent les instruments et contrôlent les installations et la marche des opérations. Dans les usines automatisées, les interventions se font à distance, à partir d’une salle de commande par exemple. La voie manuelle est utilisée le plus souvent pour le chargement ou le transfert des matières, le déchargement et le conditionnement des produits, les opérations de maintenance et les situations inhabituelles. Des instructions écrites devraient être élaborées pour définir les modes opératoires normalisés et signaler les risques pour la sécurité et la santé des travailleurs et les mesures de protection appropriées.
Les mesures visant la protection des travailleurs et celle de l’environnement devraient faire l’objet d’évaluations périodiques. Dans l’industrie pharmaceutique, de nombreux procédés de fabrication sont validés afin d’assurer la qualité des produits (Cole, 1990; Gennaro, 1990; Swarbick et Boylan, 1996). Des pratiques similaires peuvent être mises en œuvre pour garantir l’efficacité et la fiabilité des mesures de protection sur les lieux de travail. Les instructions de fabrication et les pratiques de sécurité devraient être revues périodiquement. Une maintenance préventive permettra d’éviter les défaillances du matériel. Une bonne formation des opérateurs et un encadrement attentif sont indispensables en matière de protection de la sécurité et de la santé. Ils seront complétés par des contrôles appropriés et par des audits destinés à évaluer et à prévenir les dangers pour la sécurité, la santé et l’environnement.
La pesée et la répartition des solides et des liquides sont des opérations très courantes dans l’ensemble de l’industrie pharmaceutique (Gennaro, 1990). Généralement, les solides sont répartis par prélèvement à la main, et les liquides par versement (gravité) ou pompage (pompe à vide ou pompe à piston). Ces opérations sont souvent effectuées dans un atelier de stockage lors de la fabrication de produits chimiques de base ou dans une pharmacie lors de la mise en forme pharmaceutique. Compte tenu des risques de déversement accidentel et de fuite, des mesures appropriées devraient être prises pour protéger le personnel. Il conviendrait d’effectuer la pesée et la répartition dans un local entouré de cloisons, ventilé par dilution. Les surfaces de travail devraient être lisses et étanches et être nettoyées avec soin. Une ventilation par aspiration localisée, avec des hottes à fentes horizontales, évitera le rejet de contaminants atmosphériques lors de la pesée et de la répartition de solides pulvérulents ou de liquides volatils (Cole, 1990). Pour les matières très toxiques, des mesures supplémentaires (hottes à écoulement laminaire, boîtes à gants, etc.) peuvent être nécessaires (Naumann et coll., 1996).
Au cours des opérations de fabrication pharmaceutique, des solides et des liquides sont fréquemment chargés et transvasés dans des récipients et des installations (Gennaro, 1990). Ces opérations s’effectuent souvent manuellement, mais d’autres méthodes sont aussi employées (gravité, systèmes de transfert mécaniques ou pneumatiques). L’encoffrement des machines et les systèmes de transfert permettent d’éviter l’exposition du personnel lors du chargement ou du transvasement de matières très dangereuses. Le chargement par gravité à partir de récipients isolés, ainsi que les systèmes faisant appel au vide, à la surpression ou au pompage éliminent les émissions fugitives lors des opérations de chargement et de transvasement. Une aspiration localisée efficace permettra de capter les poussières et les vapeurs pouvant s’échapper aux points de transfert non protégés.
Les liquides sont séparés en fonction de leurs propriétés physiques (densité, solubilité et miscibilité) (Kroschwitz, 1992). Les séparations de liquides sont fréquentes aussi bien lors de la fabrication de produits chimiques de base que pendant les opérations de mise en forme pharmaceutique. Les liquides dangereux devraient être transvasés, traités et séparés dans des cuves et des systèmes de tuyauteries fermées, de manière à réduire l’exposition du personnel aux émanations nocives. Il devrait y avoir des fontaines d’irrigation oculaire et des douches d’urgence à proximité des points où sont transvasés, traités ou séparés des liquides dangereux. Lorsque des liquides inflammables sont mis en œuvre, des dispositifs évitant les déversements accidentels, accompagnés de mesures appropriées de protection contre les incendies et les explosions, sont nécessaires.
Au cours des opérations pharmaceutiques, des liquides sont fréquemment transférés entre cuves de stockage, récipients divers et installations de production. Les ateliers et les procédés de fabrication devraient être conçus de manière à réduire le plus possible la nécessité de transvaser des matières dangereuses, ce qui diminue automatiquement les risques de déversement accidentel et d’exposition du personnel. Les liquides peuvent être transvasés à l’aide de rampes de distribution permettant de relier temporairement différentes canalisations (Kroschwitz, 1992). Des écoulements, des fuites et des émissions de vapeurs pouvant se produire au niveau des rampes de distribution, les tuyaux souples et les canalisations devraient être munis de joints d’étanchéité efficaces pour empêcher la pollution de l’environnement et les rejets dans les locaux de travail. Des cuvettes de rétention permettent de récupérer les liquides déversés, qui peuvent ainsi être réutilisés. Pour le transvasement de grandes quantités de liquides, il est très souhaitable d’avoir des cuves et des récipients, ainsi que des systèmes de canalisations étanches. Des précautions spéciales devraient être prises lorsqu’on utilise des gaz inertes pour mettre sous pression des lignes de transvasement ou une installation de production, car cela peut accroître les émissions de composés organiques volatils et d’autres polluants dangereux. Il est possible, grâce au recyclage ou à la condensation des gaz et des vapeurs, de limiter la pollution de l’air.
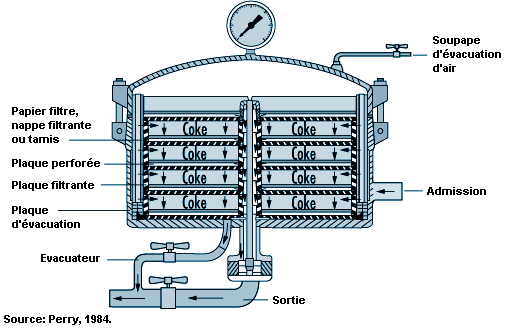
Les solides et les liquides sont séparés par filtration. Il existe différents types de filtres dont les caractéristiques diffèrent selon les substances à séparer et les liquides ou les vapeurs à traiter (Kroschwitz, 1992; Perry, 1984). L’emploi de filtres ouverts, pour des matières dangereuses, risque d’exposer les travailleurs à des liquides, à des solides humides, à des vapeurs et à des aérosols lors des opérations de chargement et de déchargement. On peut utiliser un dispositif en circuit fermé pour filtrer les matières très dangereuses, de manière à réduire les émissions de vapeur et à éviter l’exposition des opérateurs (voir figure 79.9). La filtration devrait s’effectuer dans des locaux équipés de dispositifs de protection contre les déversements accidentels et d’une bonne ventilation par dilution et aspiration localisée. Les vapeurs de solvants volatils peuvent être évacuées par des soupapes montées sur des équipements étanches avant d’être traitées par des dispositifs antipollution (condenseurs, épurateurs, adsorbeurs).
Certaines opérations sont destinées à mélanger des solides et des liquides pour préparer des solutions, des suspensions, des sirops, des pommades ou des pâtes. Pour les mélanges de matières très dangereuses, il est recommandé d’utiliser des installations étanches (Kroschwitz, 1992; Perry, 1984). Les tampons, détergents et germicides utilisés comme agents neutralisants, nettoyants ou biocides peuvent être dangereux pour le personnel. Les fontaines d’irrigation oculaire et les douches d’urgence sont efficaces en cas de contact accidentel avec des substances corrosives ou irritantes. La présence de surfaces humides dans les ateliers appelle des mesures appropriées de protection. Les opérations de mélangeage et de nettoyage comportent aussi des risques thermiques dus à l’utilisation de vapeur et d’eau chaude, ce qui conduit à isoler les surfaces chaudes. Les sols secs et dégagés permettront d’éviter les chutes.
La granulation des solides secs ou humides a pour but d’en modifier les propriétés physiques. Les granulateurs peuvent avoir des caractéristiques différentes et assurent un confinement et une maîtrise variables des risques mécaniques et des particules en suspension et des vapeurs (Perry, 1984; Swarbick et Boylan, 1996). Les granulateurs en vase clos permettent de réduire les émissions de particules ou de vapeurs de solvants dans les ateliers et dans l’atmosphère extérieure (voir figure 79.10). Pour le chargement et le déchargement de charges lourdes, les opérateurs utilisent des engins mécaniques (plates-formes élévatrices, transpalettes). Des fontaines d’irrigation oculaire et des douches d’urgence devraient être prévues pour traiter les cas de contact accidentel avec des solvants ou des particules irritantes.

De nombreuses opérations de fabrication pharmaceutique nécessitent le séchage de solides mouillés par de l’eau ou des solvants. Les séchoirs sont de différents types, chacun d’eux assurant un confinement et une maîtrise variables des vapeurs et des particules (voir figure 79.11). Les vapeurs de solvants inflammables et les particules explosibles en suspension dans l’air peuvent créer une atmosphère inflammable ou explosive. Il est essentiel que les séchoirs fonctionnant en vase clos soient pourvus d’évents d’explosion. Les systèmes de ventilation par dilution et par aspiration localisée réduisent les risques d’incendie et d’explosion et évitent d’exposer les opérateurs aux vapeurs de solvants lors de la manipulation des pains humides, ou aux particules en suspension dans l’air lors du déchargement des produits séchés. Le chargement et le déchargement des plateaux, des armoires de séchage sous vide (voir figure 79.12), des réservoirs et des étuves peuvent exiger la manutention de lourdes charges et l’utilisation d’engins mécaniques (palans, monte-charges, plates-formes élévatrices, etc.). Des fontaines d’irrigation oculaire et des douches d’urgence devraient être prévues pour traiter les cas de contact accidentel avec des solvants ou des particules irritantes.


Le broyage permet de modifier les caractéristiques particulaires des solides secs et d’obtenir des poudres à écoulement fluide. Il existe de nombreux types de broyeurs, chacun d’eux assurant un confinement et une maîtrise variables des particules en suspension dans l’air (Kroschwitz, 1992; Perry, 1984). Les propriétés physiques des produits et les risques qu’elles comportent devraient être étudiés ou testés avant toute opération de broyage. Les mesures de protection contre les explosions comprennent des équipements électriques étanches aux poussières et la mise à la terre des installations pour éliminer les charges électrostatiques, ainsi que la pose de soupapes de sûreté sur les broyeurs clos et l’installation de panneaux soufflables dans les parois. Ces mesures peuvent être nécessaires en raison de l’explosibilité de certaines substances médicamenteuses et de certains excipients, ainsi que des fortes concentrations de poussières et d’énergie associées aux opérations de broyage.
Cette opération permet d’obtenir des mélanges homogènes. Les appareils utilisés sont de divers types, chacun d’eux assurant un confinement et une maîtrise variables des risques mécaniques et des poussières en suspension dans l’air (Kroschwitz, 1992; Perry, 1984). Le personnel peut être exposé à des substances médicamenteuses, à des excipients ou à des mélanges lors du chargement et du déchargement des appareils. Les systèmes de ventilation par aspiration localisée réduisent les émissions fugitives de particules au cours des opérations. Le chargement et le déchargement des appareils peuvent exiger le recours à des engins mécaniques (plates-formes élévatrices, treuils, palans et transpalettes).
Les solides secs sont comprimés dans des machines très puissantes qui fabriquent des «briquettes». Ces machines sont de divers types, chacun d’eux assurant un confinement et une maîtrise variables des risques mécaniques et des particules en suspension dans l’air (Gennaro, 1990; Swarbick et Boylan, 1996). Les machines à comprimer peuvent présenter des risques graves si elles ne sont pas convenablement protégées. Les opérations de compression (briquetage) peuvent aussi s’accompagner de niveaux de bruit élevés que l’on peut réduire en encoffrant les sources d’impact, en isolant les matériels vibrants, en prévoyant une rotation des employés et en utilisant des protecteurs d’ouïe.
Les formes pharmaceutiques orales les plus courantes sont les comprimés et les gélules (capsules à enveloppe dure). Les comprimés préparés par compression contiennent des mélanges de substances actives et d’excipients. Ils peuvent être enrobés ou non, l’enrobage faisant intervenir des mélanges de solvants, des résines, des cires, etc. L’enveloppe des gélules est presque toujours faite de gélatine pure. Les machines à comprimer (voir figure 79.13), à enrober et à remplir les gélules sont de plusieurs types, chacun d’eux assurant un confinement et une maîtrise variables des risques mécaniques et des poussières en suspension dans l’air (Cole, 1990). Les opérateurs peuvent être exposés à des vapeurs de solvants lors des opérations d’enrobage par pulvérisation ou saupoudrage. Les enrobeuses modernes sont parfaitement étanches; sur les anciennes cuves d’enrobage, des systèmes de ventilation par aspiration localisée peuvent être installés pour lutter contre les émissions de vapeurs de solvants. Les enrobeuses ouvertes peuvent être reliées à des bouches d’air pour capter les émissions de composés organiques volatils (voir figure 79.14). Lorsque cela est possible, il serait indiqué de récupérer les solvants utilisés ou de remplacer les solvants par des mélanges aqueux pour l’enrobage. Les machines modernes sont protégées par des carters verrouillés, ce qui réduit les risques mécaniques, les niveaux de bruit et l’empoussièrement. Le port de protecteurs d’oreilles est recommandé pour les opérateurs affectés à la fabrication des comprimés et des gélules.


Les préparations qui doivent être stériles sont fabriquées et conditionnées dans des unités de production modulaires (voir figure 79.15) dont les surfaces de travail et les installations sont d’une propreté rigoureuse et dotées de systèmes de filtrage de l’air à haut rendement (HEPA) (Cole, 1990; Gennaro, 1990). Les méthodes utilisées pour prévenir la contamination lors de la préparation de solutions stériles sont analogues à celles de la microélectronique. Les opérateurs devraient porter des vêtements de protection pour éviter qu’ils ne contaminent les produits qui doivent être stériles. Les techniques mises en œuvre comprennent la lyophilisation (dessiccation par congélation et sublimation de la glace formée), l’utilisation de germicides liquides ou de gaz stérilisants, la mise en place d’une ventilation à écoulement laminaire, l’isolement des différents modules par des pressions d’air différenciées et la mise en vase clos des appareils de fabrication et de remplissage.
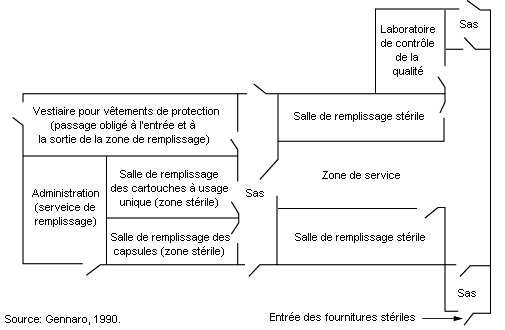
Les germicides et les gaz stérilisants toxiques (tels que le formaldéhyde et le glutaraldéhyde, d’une part, et l’oxyde d’éthylène, d’autre part) comportent des risques chimiques. Il convient, partout où cela est possible, de choisir des substances moins dange-reuses (alcools, composés d’ammonium). On peut stériliser les matières premières et les appareils en utilisant de la vapeur sous haute pression ou des gaz toxiques (mélanges d’oxyde d’éthylène dilués, par exemple) (Swarbick et Boylan, 1996). Les cuves de stérilisation devraient être situées à l’écart et équipées de dispositifs de commande à distance et de systèmes de ventilation par aspiration localisée pour l’extraction des gaz toxiques; toute remise en circulation de l’air devrait être exclue. La formation des opérateurs devrait inclure les méthodes de fabrication, les mesures de sécurité et les interventions d’urgence. Afin de limiter le plus possible les émissions indésirables, il faudrait évacuer complètement sous vide les chambres de stérilisation et les purger à l’air avant d’en décharger les produits stérilisés. Les gaz provenant des chambres de stérilisation peuvent être traités dans des convertisseurs à adsorption sur charbon ou catalytiques, ce qui permet de réduire les rejets dans l’atmosphère. L’exposition des opérateurs aux germicides chimiques et aux gaz stérilisants sera mesurée afin d’évaluer l’efficacité des mesures mises en œuvre. Les autres risques sont liés à la vapeur à haute pression, à l’eau chaude, aux machines en mouvement (lavage, remplissage, encapsulage, conditionnement), aux niveaux élevés de bruit et aux tâches manuelles répétitives.
Les tâches de nettoyage, de maintenance et de réparation peuvent comprendre l’exécution de travaux peu courants. Ceux-ci comportent des risques différents dans chaque cas, risques qui devraient être étudiés avec un soin particulier. Les postes de travail et les installations peuvent être contaminés par des matières premières et par des substances médicamenteuses dangereuses; il importe dès lors qu’ils soient parfaitement nettoyés avant que des travailleurs non protégés ne procèdent à des travaux de maintenance. Un nettoyage efficace consiste à laver, balayer, absorber des liquides et aspirer des poussières. Il est déconseillé de balayer à sec ou de disperser les solides pulvérulents à l’air comprimé, car ces méthodes entraînent une forte exposition du personnel aux poussières en suspension dans l’air, alors que le nettoyage à l’eau et l’aspiration la réduisent. Il peut être nécessaire d’utiliser des aspirateurs munis de filtres HEPA pour éliminer les substances dangereuses ou les médicaments à haute activité, ainsi que du matériel antidéflagrant et des matériaux conducteurs pour aspirer les particules explosibles. Des fontaines d’irrigation oculaire, des douches d’urgence et des équipements de protection individuelle permettront de limiter les effets d’un contact accidentel avec des détergents ou des liquides de nettoyage corrosifs ou irritants.
Il est en général indispensable de couper les sources d’énergie mécanique, électrique, pneumatique ou thermique avant d’entreprendre une opération quelconque de réparation ou de maintenance sur des installations de fabrication. Si l’on recourt à des contractuels pour exécuter des travaux spéciaux dans une usine pharmaceutique, il importe de les surveiller de près afin qu’ils se conforment aux règles de sécurité et n’effectuent pas d’opération entraînant un risque d’incendie ou d’explosion, ou tout autre risque grave pour la sécurité et la santé. Des programmes de sécurité spécifiques devraient être élaborés pour cette catégorie de personnes lorsqu’elles ont affaire à des produits (par exemple, toxiques, réactifs, inflammables ou explosibles) ou à des procédés (par exemple, exothermiques ou mettant en œuvre des pressions très élevées) très dangereux dans les ateliers de fabrication de matières actives ou de produits finis.
Les opérations de conditionnement sont exécutées en général par des machines automatiques à très haute cadence, plus rarement à la main par des gestes répétitifs (Gennaro, 1990; Swarbick et Boylan, 1996). Les produits finis sous forme pharmaceutique peuvent être conditionnés dans de nombreux emballages (flacons de verre ou de matière plastique, boîtes, pots, tubes, bandes plus ou moins souples à alvéoles préformées ou non, sachets, ampoules stériles, etc.). Pour les comprimés, la tendance est au conditionnement unitaire sous bande de papier ou autre matière. Des machines procèdent au remplissage, à la fermeture, à l’étiquetage et à la mise en cartons en vue de l’expédition. Elles sont en général modernes et bien protégées, pourvues de dispositifs d’arrêt d’urgence. L’encoffrement et l’isolation phonique des installations permettent de réduire les niveaux de bruit et de vibrations dans les ateliers de conditionnement; le port de protecteurs d’oreilles s’impose néanmoins dans certaines situations. Une conception rationnelle tenant compte des exigences de l’ergonomie favorise la productivité, le confort et la sécurité des travailleurs en évitant, notamment, les mauvaises postures, les risques liés à l’alimentation des machines et à la manutention des produits, de même que les tâches hautement répétitives.
Dans l’industrie pharmaceutique, les tâches effectuées en laboratoire sont nombreuses et très variées. Elles peuvent exposer à des risques biologiques, chimiques et physiques dont la nature et l’importance dépendent des agents mis en œuvre, du matériel utilisé et des méthodes de travail appliquées. Il existe des différences majeures entre les laboratoires qui mènent des recherches scientifiques et mettent au point des produits et des procédés, d’une part, et ceux qui sont chargés de l’assurance et du contrôle de la qualité, d’autre part (Swarbick et Boylan, 1996). Le personnel de laboratoire peut se livrer à des recherches pour découvrir de nouvelles substances médicamenteuses, mettre au point des procédés de fabrication pour les produits chimiques de base ou les formes pharmaceutiques, ou encore analyser des matières premières, des produits intermédiaires ou des produits finis. Les activités de laboratoire devraient être évaluées cas par cas, même si les pratiques éprouvées s’appliquent à la plupart des situations (National Research Council (NRC),1981). Des responsabilités clairement définies, une formation et des informations appropriées, des mesures de protection suffisantes, des plans d’urgence et des audits périodiques contribuent de façon notable à une bonne gestion des risques pour la sécurité, la santé et l’environnement.
Il est possible de réduire sensiblement les risques liés aux produits inflammables, explosibles ou toxiques en ne stockant dans les laboratoires que les quantités minimales requises et en les plaçant dans des armoires séparées en fonction des risques qui leur sont propres. Les opérations de laboratoire et les essais susceptibles de libérer des contaminants atmosphériques devraient être réalisés sous des hottes permettant de capter les poussières, les vapeurs et les fumées. Les hottes de biosécurité assurent un écoulement laminaire dirigé vers le bas et vers l’intérieur, ce qui empêche la dissémination de micro-organismes (Gennaro, 1990; Swarbick et Boylan, 1996). La formation et l’information du personnel porteront sur les risques liés au travail en laboratoire, les pratiques de sécurité et les mesures d’urgence à appliquer en cas d’incendie ou de déversement accidentel. Il faut éviter de consommer des aliments ou des boissons dans les laboratoires. Les opérations inhabituelles et les interventions présentant des risques particuliers devraient être préparées et supervisées par une personne compétente. Les déchets biologiques et chimiques devraient être collectés, séparés, traités et éliminés. Les risques physiques (sources de rayonnements ionisants ou non ionisants) sont souvent gérés selon des règles spécifiques.
Les matières mises en œuvre, traitées, stockées, conditionnées et expédiées dans l’industrie pharmaceutique vont de matières premières en quantités importantes à de petits emballages de produits pharmaceutiques. Les matières premières servant à la fabrication des produits chimiques de base sont expédiées dans des conteneurs (camions-citernes, bateaux-citernes ou wagons), des fûts de métal ou de fibre, des sacs de papier renforcé ou de matière plastique. L’industrie pharmaceutique utilise des quantités relativement faibles de matières premières en raison de l’échelle réduite de sa production. Les manutentions, au niveau du stockage ou de la fabrication, s’effectuent à l’aide d’engins ou d’auxiliaires de manutention (chariots élévateurs à fourche, lève-palettes, treuils, plates-formes élévatrices, palans, etc.). En l’absence de dispositifs mécaniques, le soulèvement et le transport de charges pesantes peuvent provoquer des lombalgies et des hernies discales, notamment. Ces risques sont atténués si l’on réduit l’encombrement et le poids des charges à déplacer (Cole, 1990). Grâce à une conception ergonomique des outils et des matériels, à une rotation des équipes et à une bonne formation du personnel, les risques pour la santé pourront être en grande partie évités, en particulier dans les opérations de conditionnement qui ont un caractère répétitif prononcé.
Toute pièce de machine en mouvement peut être source de risques mécaniques si elle est accessible et n’est pas convenablement protégée. C’est le cas, par exemple, des presses mécaniques, des malaxeurs et des broyeurs. Ces risques sont exacerbés par le nombre et la diversité des équipements, l’encombrement des ateliers et la fréquence des interventions dans certains cas. Les mesures de protection sont les mêmes que pour les matériels similaires d’autres industries. Les cheveux longs, les manches flottantes, les bagues et autres objets peuvent être pris dans une machine. Les sources d’énergie (électrique, mécanique, pneumatique, thermique) dangereuses devraient être neutralisées ou coupées avant toute intervention sur des machines ou des installations en marche. Les procédures usuelles (autorisations de travail, systèmes de verrouillage, etc.) jouent un rôle important.
Les installations de production et les sources d’énergie qui les alimentent, de même que les systèmes de ventilation, peuvent être à l’origine de niveaux sonores élevés. Les postes de travail étant généralement conçus de manière à être isolés, les opérateurs se trouvent souvent à proximité des machines qu’ils surveillent et sont donc davantage exposés au bruit. Les niveaux sonores peuvent être atténués en appliquant des mesures techniques connues et en mettant à disposition du personnel exposé, le cas échéant, des protecteurs appropriés. Un programme de surveillance du bruit et un suivi (audiométrie) permettront d’évaluer l’exposition au bruit et les pertes auditives qui peuvent en résulter. Il sera ainsi possible de déterminer si les mesures correctives appliquées sont efficaces.
L’exposition aux vapeurs de solvants toxiques et à des médicaments puissants présents sous forme de particules en suspension dans l’air peut poser des problèmes particuliers. Les mesures les plus efficaces dans ces cas sont celles qui relèvent de la prévention technique collective, en raison également de leur fiabilité intrinsèque (Cole, 1990; Naumann et coll., 1996). Ces mesures (parmi lesquelles une ventilation par aspiration localisée occupe une place de choix) pourront, en cas de besoin, être complétées par des équipements de protection individuelle. Un confinement rigoureux des installations s’impose dans le cas de solvants hautement toxiques (benzène, hydrocarbures chlorés, cétones) et de composés puissants, ainsi que le port d’appareils de protection respiratoire à pression positive (par exemple à adduction d’air filtré). Les opérations qui donnent lieu à de fortes concentrations de vapeurs de solvants (mélangeage, granulation, enrobage) ou de poussières (séchage, broyage, homogénéisation) appellent des précautions spéciales. Des vestiaires, des douches, des installations de décontamination et une bonne hygiène individuelle sont nécessaires pour prévenir ou limiter les effets de l’exposition des travailleurs aux substances considérées.
L’industrie pharmaceutique met en place d’importants program-mes de sécurité et de protection de la santé en raison des risques liés aux réactions chimiques complexes, aux matières dangereuses mises en œuvre et aux opérations de fabrication des produits chimiques de base (Crowl et Louvar, 1990). Ces opérations peuvent comporter des risques particulièrement élevés lorsqu’il s’agit des réactions de synthèse organique à plusieurs étages. Il est nécessaire d’évaluer les caractéristiques thermodynamiques et le comportement de ces réactions, car elles peuvent faire intervenir des matières hautement toxiques et réactives, des substances lacrymogènes, des composés inflammables ou explosibles, etc. La gestion de la sécurité comporte dans ce cas des tests physiques des substances et de leurs réactions, des analyses des risques et des procédés, la recherche des mesures à mettre en œuvre pour éviter les accidents et les atteintes à la santé, le rôle de la maintenance préventive, l’instauration de programmes de formation appropriés et l’élaboration de consignes d’exploitation et de procédures d’urgence. Les mesures de sécurité spéciales à prendre comprennent le choix de récipients capables de résister aux pressions prévues, la mise en place de dispositifs d’isolement et de coupure, des soupapes de surpression et des bassins de rétention. Les méthodes de gestion de la sécurité sont d’ailleurs similaires à celles pratiquées par 1’industrie (Crowl et Louvar, 1990; Kroschwitz, 1992.
Les différents procédés de fabrication de l’industrie pharmaceutique donnent tous lieu à des problèmes d’environnement particuliers, comme mentionné ci-après.
La fermentation produit d’importants volumes de déchets solides contenant du mycélium et des résidus de filtration (EPA, 1995; Theodore et McGuinn, 1992). Ces résidus sont composés de mycélium, du matériau filtrant lui-même, de petites quantités d’éléments nutritifs, de produits intermédiaires et de produits résiduels. Ces déchets solides ne sont généralement pas dangereux, mais ils peuvent contenir des solvants et de petites quantités de substances chimiques résiduelles, selon les réactions chimiques intervenant dans le processus de fermentation. Des problèmes d’environnement peuvent se poser si des lots de fermentation sont contaminés par un phage viral qui attaque les micro-organismes au cours de la fermentation. Bien que de telles infections soient rares, elles créent des problèmes d’environnement importants, car elles entraînent la production de grandes quantités d’effluents liquides.
Les résidus de fermentation liquides contiennent des sucres, des amidons, des protéines, de l’azote, des phosphates et d’autres éléments nutritifs ayant de fortes demandes biochimiques (DBO) et chimiques (DCO) en oxygène, et un total des solides en suspension (TSS) caractérisé par un pH compris entre 4 et 8. Ces résidus peuvent être traités par des systèmes microbiologiques d’épuration des eaux usées, après équilibrage de l’effluent pour assurer la régularité du système de traitement. De la vapeur et de petites quantités de produits chimiques industriels (tels que phénols, détergents et désinfectants) permettent de maintenir la stérilité des équipements et des produits pendant la fermentation. Les fermenteurs libèrent d’importants volumes d’air humide chargé de dioxyde de carbone et d’odeurs qui peuvent être traités avant d’être rejetés dans l’atmosphère.
Les déchets issus des synthèses organiques sont complexes, en raison de la diversité des substances dangereuses, des réactions et des opérations unitaires (Kroschwitz, 1992; Theodore et McGuinn, 1992). Les procédés utilisés peuvent générer des acides, des bases, des liqueurs aqueuses ou des liqueurs de solvants, des cyanures et des déchets métalliques sous forme de liquides ou de boues. Les déchets solides peuvent comprendre des résidus de filtration contenant des sels minéraux, des sous-produits organiques et des complexes métalliques. Les solvants à éliminer sont généralement récupérés par distillation et extraction, ce qui permet de les réutiliser pour d’autres opérations et réduit ainsi le volume de déchets liquides dangereux à éliminer. Les résidus de distillation (fonds de cuve) seront traités avant d’être éliminés. Les systèmes de traitement classiques incluent une distillation à la vapeur pour éliminer les solvants, suivie d’un traitement microbiologique des autres composés organiques. Les émissions de composés organiques volatils et de substances dangereuses sont récupérées par des dispositifs antipollution (condenseurs, épurateurs-laveurs, impacteurs Venturi, etc.).
L’eau résiduelle peut contenir des solutions aqueuses, de l’eau de lavage, des rejets de pompes, d’épurateurs-laveurs et de systèmes de refroidissement ainsi que des substances provenant d’émissions fugitives ou de déversements accidentels (EPA, 1995). Elle peut donc renfermer de nombreuses substances organiques ou inorganiques ayant des compositions chimiques, des toxicités et des biodégradabilités différentes. Des matières premières, des solvants et des sous-produits peuvent être présents à l’état de traces dans les liqueurs mères aqueuses issues des cristallisations ainsi que dans les couches d’eau provenant des extractions et du nettoyage du matériel. Ces eaux usées ont une DBO, une DCO et un TSS élevés, avec une acidité et une alcalinité variables, et un pH pouvant aller de 1 à 11.
Les matières premières et les solvants résiduels, l’eau de lavage et les déversements accidentels sont les principales sources de déchets solides et liquides (Theodore et McGuinn, 1992) susceptibles de contenir des produits chimiques organiques et inorganiques sous forme de résidus. Généralement, les eaux usées ont une DBO, une DCO et un TSS faibles, et leur pH est relativement neutre, se situant entre 6 et 8.
La mise en forme pharmaceutique produit des déchets solides et liquides dus au nettoyage, à la stérilisation, aux fuites, aux déversements accidentels et aux produits rejetés (Theodore et McGuinn, 1992). Les opérations de séchage, de broyage et d’homogénéisation donnent lieu à des émissions atmosphériques et à des émissions fugitives de poussières, émissions qui peuvent être recyclées pour la fabrication des produits, sauf si les procédures de contrôle de la qualité révèlent la présence d’autres résidus. Lorsque des solvants sont utilisés pour la granulation par voie humide, le mélangeage et l’enrobage, des composés organiques volatils et des polluants dangereux peuvent être libérés dans l’atmosphère ou dans les ateliers, sous forme d’émissions fugitives ou inhérentes au procédé. Les eaux usées peuvent contenir des sels minéraux, des sucres, des sirops et des traces de substances médicamenteuses. Elles ont généralement une DBO, une DCO et un TSS faibles, avec un pH neutre. Certains médicaments antiparasitaires ou anti-infectieux destinés à l’humain ou à l’animal peuvent être toxiques pour les organismes aquatiques, ce qui nécessite un traitement spécial des déchets liquides.
Il est possible, grâce à des mesures qui relèvent de la technologie et de l’administration, de limiter l’impact des opérations de fabrication des produits chimiques de base et des produits pharmaceutiques finis sur l’environnement. La prévention de la pollution passe par l’amélioration des procédés et des installations, le recyclage et la récupération des substances, le maintien de l’ordre et de la propreté et l’application de bonnes méthodes d’exploitation (Theodore et McGuinn, 1992). Ces mesures contribuent à une meilleure protection de l’environnement et à l’amélioration des conditions de sécurité et de santé du personnel.
Les procédés de fabrication peuvent être améliorés, par exemple en reformulant des produits de manière à recourir à des substances moins dangereuses ou moins persistantes, ou encore en modifiant les opérations de fabrication afin de diminuer les rejets dans l’atmosphère, ainsi que les quantités d’effluents liquides et de déchets solides. Toute réduction du volume ou de la toxicité des déchets s’accompagne d’une plus grande efficacité des procédés de fabrication et d’une baisse du coût qu’implique l’élimination de ces déchets. Les règlements officiels concernant l’approbation des médicaments peuvent limiter les possibilités qu’ont les fabricants d’apporter des modifications au choix des matières mises en œuvre, aux procédés de fabrication, aux équipements et aux locaux (Spilker, 1994). L’industrie pharmaceutique doit donc s’efforcer d’anticiper les effets de ces choix sur l’environnement, la sécurité et la santé. Il devient en effet de plus en plus difficile d’apporter des modifications aux stades ultérieurs de la mise au point et de l’approbation réglementaire des médicaments sans perdre beaucoup de temps et d’argent.
Il est hautement souhaitable de mettre au point des procédés de fabrication utilisant des solvants moins dangereux. L’acétate d’éthyle, les alcools et l’acétone sont préférables aux solvants très toxiques tels que le benzène, le chloroforme et le trichloroéthylène. Il faudrait, dans la mesure du possible, éviter certaines substances en raison de leurs propriétés physiques dangereuses, de leur écotoxicité ou de leur persistance dans l’environnement (cas des métaux lourds et du chlorure de méthylène, par exemple) (Crowl et Louvar, 1990). Le remplacement des solvants par des solutions de lavage aqueuses dans les opérations de filtration qui font partie de la fabrication des produits chimiques de base permet de réduire les quantités de déchets liquides et les émissions de vapeurs. De même, le remplacement des solutions à base de solvants par des solutions aqueuses pour l’enrobage des comprimés atténue les effets sur l’environnement et améliore la sécurité et la santé. Les perfectionnements apportés aux équipements et leur automatisation, ainsi que des contrôles systématiques et une maintenance préventive vont dans le même sens. L’optimisation des réactions de synthèse organique améliore les rendements et réduit fréquemment la production de déchets. Des dispositifs inadéquats ou inefficaces de régulation de la température, de la pression ou de contrôle des matières mises en œuvre se traduisent par des réactions chimiques inefficaces et donnent lieu à des déchets gazeux, liquides et solides supplémentaires.
Les exemples ci-après illustrent diverses mesures visant à modifier les procédés dans la fabrication des matières pharmaceutiques de base (Theodore et McGuinn, 1992):
La récupération consiste à tirer parti des déchets et à récupérer des matières en cours de fabrication, en les séparant des impuretés à éliminer. Les déchets solides issus de la fermentation (mycélium) peuvent être ajoutés aux aliments pour animaux comme compléments nutritionnels ou être utilisés pour le conditionnement des sols ou comme engrais. Des sels minéraux peuvent être récupérés à partir des liqueurs chimiques produites dans les opérations de synthèse organique. Les solvants résiduaires sont souvent recyclés par séparation et distillation. Les dispositifs de régulation des émissions d’air (condenseurs, compresseurs, matériel de réfrigération) réduisent considérablement les émissions de composés organiques volatils dans l’atmosphère (EPA, 1993). Ils captent les vapeurs de solvants par condensation, ce qui permet de réutiliser ceux-ci comme matières premières ou pour le nettoyage des cuves et autres installations. Les épurateurs-laveurs neutralisent ou absorbent les gaz et vapeurs acides, caustiques et solubles en envoyant leurs effluents dans des systèmes de traitement des déchets.
Les solvants recyclés peuvent être utilisés dans des réactions et des extractions et pour des opérations de nettoyage. Il faut éviter de mélanger des solvants de types différents, car il est alors plus difficile de les recycler. Certains devraient être séparés en cours de fabrication (par exemple, les solvants chlorés et non chlorés, aliphatiques et aromatiques, aqueux et inflammables). Les solides en solution ou en suspension sont extraits ou séparés des solvants avant la récupération de ceux-ci. Les analyses de laboratoire permettent d’identifier la composition et les propriétés des solvants résiduaires et des matières premières recyclées. De nombreuses technologies nouvelles de prévention et de contrôle de la pollution sont en cours d’élaboration pour les déchets solides, liquides ou gazeux.
Des modes opératoires écrits, des instructions concernant la manutention des matières et la gestion des déchets permettent de réduire la quantité de déchets et d’améliorer leur traitement (Theodore et McGuinn, 1992). Les responsabilités devraient être fixées de manière précise en matière de production, de manutention et de traitement des déchets. Grâce à une formation appropriée et à un bon encadrement, les opérateurs seront en mesure d’accroître l’efficacité des opérations de fabrication et de gestion des déchets. Ils devraient être familiarisés avec les risques liés à la gestion des déchets ainsi qu’avec les plans d’urgence à appliquer en cas de déversements accidentels, de fuites ou d’émissions dangereuses. Leur formation devrait inclure la manutention correcte, le nettoyage ou la neutralisation des déchets, ainsi que l’utilisation des équipements de protection individuelle.
Des instructions écrites décrivant les modes opératoires ordinaires, les procédures de mise en route et d’arrêt ainsi que les procédures d’urgence contribueront à prévenir les pollutions de divers types et à maîtriser les risques éventuels. Une gestion attentive des stocks de matières permettra d’éviter les achats excessifs de matières premières et de réduire le volume des déchets. L’informatique peut être un moyen très utile de bien gérer l’activité de l’usine, les opérations de maintenance et les stocks de matières. Des systèmes automatiques de pesée, de surveillance et d’alarme peuvent être installés pour améliorer la gestion des matières et la sécurité des installations (cuves de stockage, appareils de fabrication et systèmes de traitement des déchets). Les programmes globaux de prévention de la pollution devraient prendre en compte tous les déchets produits dans une usine et étudier les différents moyens de les éliminer, de les réduire ou de les traiter. Les audits d’environnement examineront les points forts et les lacunes des programmes de prévention de la pollution et de gestion des déchets et contribueront à accroître leur efficacité.