

Le nombre des personnes qui travaillent à des altitudes élevées ne cesse d’augmenter. L’exploitation minière, les loisirs, les transports, les travaux agricoles et les opérations militaires se déroulent souvent à grande altitude et font tous appel à une activité humaine physique et mentale qui exige des besoins accrus en oxygène. Mais au fur et à mesure que l’on s’élève au-dessus du niveau de la mer, la pression d’air totale (pression barométrique, PB) et la quantité d’oxygène dans l’air ambiant (part de la pression totale liée à l’oxygène Po2) diminuent progressivement. Il en résulte que la quantité de travail que l’on peut accomplir diminue elle aussi progressivement. Le déroulement des travaux s’en trouve affecté. On a constaté, par exemple, que le temps nécessaire à la construction d’une galerie à une altitude de 3 300 m, dans le Colorado, était supérieur de 25% à celui d’un travail comparable au niveau de la mer. Le retard constaté était imputable aux effets de l’altitude qui entraînaient non seulement une fatigue musculaire accrue, mais aussi une dégradation des facultés mentales. La mémoire, la capacité de calcul ainsi que la prise de décisions et le jugement étaient affectés. Des scientifiques qui effectuaient des calculs à l’Observatoire de Mona Loa à Hawaï, à une altitude de plus de 4 000 m, ont constaté que ce travail leur prenait plus de temps et qu’ils faisaient davantage d’erreurs qu’au niveau de la mer. En raison de l’accroissement de l’ampleur, de l’étendue, de la variété et de la répartition des activités humaines, le nombre des personnes qui travaillent à grande altitude est en augmentation et les effets de l’altitude deviennent une question qui concerne le monde du travail.
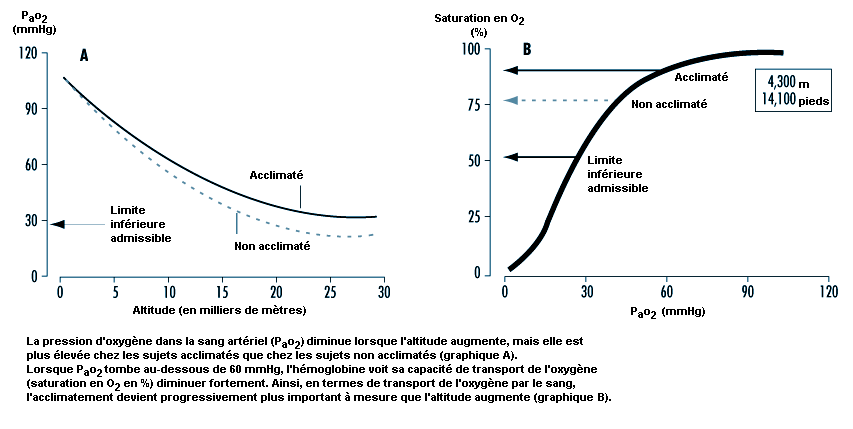
Le maintien de l’alimentation des tissus en oxygène a une importance déterminante sur les résultats du travail en altitude. L’humain, de même que d’autres animaux, possède des défenses contre les déficiences en oxygène (hypoxie). La principale d’entre elles est l’augmentation de la respiration (ventilation) qui commence lorsque la pression d’oxygène dans le sang artériel (Pao2) diminue (hypoxémie); elle se manifeste à toutes les altitudes au-dessus du niveau de la mer, croît avec l’altitude et constitue notre défense la plus efficace contre les faibles concentrations d’oxygène dans l’environnement. Le processus par lequel la respiration s’intensifie à haute altitude est appelé acclimatement ventilatoire. Son importance est mise en lumière à la figure 37.1, qui montre que la pression d’oxygène dans le sang artériel est plus élevée chez les sujets acclimatés que chez les sujets non acclimatés. De plus, le rôle joué par l’acclimatement dans le maintien de la pression d’oxygène dans le sang artériel augmente progressivement avec l’altitude. En fait, une personne non acclimatée ne pourrait pas survivre au-delà de 6 000 m, alors que des personnes acclimatées ont pu faire l’ascension de l’Everest (8 848 m) sans source d’oxygène artificielle.
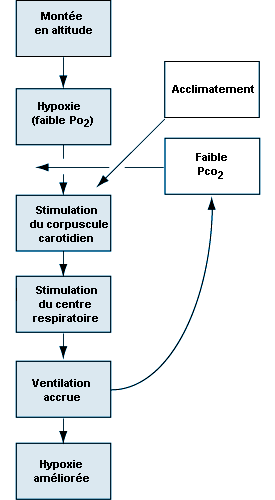
Le stimulus de l’accroissement de la ventilation à haute altitude prend largement et presque exclusivement naissance dans un tissu qui contrôle la pression d’oxygène dans le sang artériel et qui est contenu dans un organe appelé corpuscule carotidien, de la grosseur d’une tête d’épingle environ, situé à la jonction de chacune des deux artères carotides, au niveau de l’angle de la mâchoire. Si la pression d’oxygène dans le sang artériel diminue, des cellules du corpuscule carotidien analogues aux cellules nerveuses (cellules chémoréceptrices) du corpuscule carotidien décèlent cette diminution et réagissent en augmentant la fréquence des décharges le long du neuvième nerf crânien qui conduit les impulsions directement au centre respiratoire du tronc cérébral. Lorsque le centre respiratoire reçoit un nombre accru d’impulsions, il stimule une augmentation de la fréquence et de l’amplitude de la respiration par des voies nerveuses complexes qui activent le diaphragme et les muscles de la paroi thoracique. Il en résulte une augmentation de la quantité d’air ventilée par les poumons, comme il ressort de la figure 37.2, ce qui a pour effet de rétablir la pression d’oxygène artériel. Si un sujet respire de l’oxygène ou un air enrichi en oxygène, c’est l’inverse qui se produit. La fréquence des impulsions des cellules chémoréceptrices diminue, ce qui réduit la fréquence des décharges nerveuses vers le centre respiratoire et ralentit la respiration. Ces petits organes, situés de part et d’autre du cou, sont très sensibles aux faibles variations de la pression d’oxygène dans le sang. De plus, ils sont presque entièrement responsables du maintien de la quantité d’oxygène dans l’organisme, car lorsqu’ils sont tous deux endommagés ou supprimés, la ventilation n’augmente plus lorsque la teneur du sang en oxygène diminue. La pression d’oxygène artériel joue donc un grand rôle dans le contrôle de la respiration: une diminution de la concentration d’oxygène conduit à une augmentation de la respiration, et une augmentation de cette concentration entraîne une diminution de la respiration. Dans chaque cas, le résultat correspond effectivement à l’effort fait par l’organisme pour maintenir les niveaux d’oxygène sanguin sensiblement constants.
L’oxygène est nécessaire au maintien de la production d’énergie; une réduction de l’alimentation des tissus en oxygène (hypoxie) peut entraîner une dépression de la fonction des tissus. De tous les organes, le cerveau est celui qui est le plus sensible au manque d’oxygène et, comme il a été dit plus haut, certains centres du système nerveux central jouent un rôle dans le contrôle de la respiration. Lorsqu’on respire un mélange pauvre en oxygène, on commence par réagir en augmentant la ventilation, mais après dix minutes environ, cette augmentation marque un certain ralentissement. On ne connaît pas l’origine de ce phénomène, mais on pense qu’il pourrait s’agir d’une dépression d’une certaine fonction du système nerveux central liée au processus de la ventilation, qu’on a coutume d’appeler dépression ventilatoire hypoxique. Cette dépression a été observée peu de temps après une montée jusqu’à une altitude élevée. Elle est transitoire, puisqu’elle ne dure que quelques heures, peut-être parce qu’il existe une certaine adaptation des tissus du système nerveux central.
En général, une certaine augmentation de la ventilation commence dès qu’on se rend en haute altitude, bien qu’un délai soit nécessaire pour atteindre la ventilation maximale. A l’arrivée en altitude, l’augmentation de l’activité du corpuscule carotidien tend à accroître la ventilation et donc à élever la pression d’oxygène artériel pour rétablir sa valeur au niveau de la mer. Mais l’organisme est alors confronté à un dilemme. Une augmentation de la respiration entraîne un accroissement de l’élimination de dioxyde de carbone (CO2) dans l’air expiré. Dans les tissus organiques, le CO2 crée une solution aqueuse acide et, lorsqu’il est évacué dans l’air expiré, les fluides organiques, y compris le sang, deviennent plus alcalins, ce qui modifie l’équilibre acido-basique de l’organisme. Le dilemme réside dans le fait que la ventilation est régulée non seulement pour maintenir la pression d’oxygène constante, mais aussi pour assurer l’équilibre acido-basique. Le CO2 régule la respiration dans le sens opposé à la régulation produite par l’oxygène. Lorsque la pression de CO2 (c’est-à-dire le degré d’acidité en un point quelconque du centre respiratoire) augmente, la ventilation augmente également et lorsqu’elle diminue, la ventilation est réduite. A l’arrivée en haute altitude, toute augmentation de la ventilation provoquée par la faible concentration de l’oxygène dans l’environnement conduit à une baisse de la pression de CO2 qui provoque une alcalose et s’oppose à l’augmentation de la ventilation (voir figure 37.2). L’organisme ne peut donc pas maintenir constants à la fois la pression d’oxygène et l’équilibre acido-basique. Pour surmonter cette difficulté et retrouver un équilibre satisfaisant, l’être humain a besoin d’un grand nombre d’heures et même de jours.
Cet équilibre peut être rétabli par l’action des reins qui augmentent l’évacuation des bicarbonates alcalins dans les urines, ce qui compense la perte d’acidité par la respiration et contribue ainsi à réinstaurer l’équilibre acido-basique du corps à des valeurs correspondant au niveau de la mer. L’excrétion rénale des bicarbonates est un processus relativement lent. Par exemple, lorsqu’on passe du niveau de la mer à 4 300 m, l’acclimatement nécessite de 7 à 10 jours (voir figure 37.3). On pensait auparavant que cette action des reins, qui diminue l’inhibition alcaline de la ventilation, expliquait en majeure partie pourquoi la ventilation n’augmente que lentement après une montée en altitude, mais des travaux plus récents attribuent un rôle prédominant à une augmentation progressive de la sensibilité hypoxique des corpuscules carotidiens dans les premières heures ou les premiers jours qui suivent une montée en altitude. C’est ce que l’on appelle l’intervalle d’acclimatement ventilatoire. Le processus d’acclimatement permet en effet à la ventilation d’augmenter en réponse à une faible pression d’oxygène artériel malgré une diminution de la pression de CO2. A mesure que la ventilation augmente et que la pression de CO2 diminue avec l’acclimatement en altitude, il en résulte une augmentation concomitante de la pression d’oxygène dans les alvéoles pulmonaires et le sang artériel.
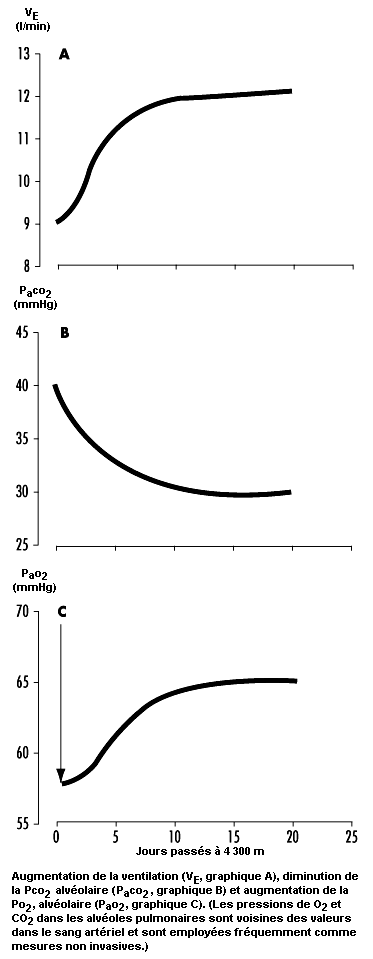
En raison de la possibilité d’une dépression ventilatoire hypoxique transitoire en altitude et du fait que l’acclimatement est un processus qui commence uniquement lorsqu’on arrive dans un environnement pauvre en oxygène, la pression d’oxygène dans le sang artériel prend une valeur minimale à l’arrivée en altitude. Elle augmente ensuite relativement rapidement dans les premiers jours, puis plus lentement, comme le montre la figure 37.3. Compte tenu que l’hypoxie s’aggrave peu de temps après l’arrivée, la léthargie et les symptômes qui accompagnent l’exposition à l’altitude sont également plus graves dans les premières heures et les premiers jours. Avec l’acclimatement, on retrouve en général un sentiment de bien-être.
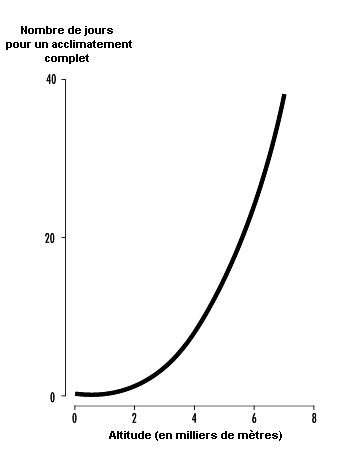
Le temps nécessaire à l’acclimatement augmente avec l’altitude, ce qui ne saurait surprendre puisque la compensation rénale met plus longtemps pour se produire lorsque l’augmentation de la ventilation et des ajustements acido-basique est plus forte. Ainsi, alors qu’un acclimatement à 3 000 m peut nécessiter 3 à 5 jours pour une personne résidant au niveau de la mer, une adaptation complète, à des altitudes au-delà de 6 000 à 8 000 m, à supposer qu’elle soit possible, peut nécessiter 6 semaines ou plus (voir figure 37.4). Lorsqu’une personne adaptée à l’altitude revient au niveau de la mer, le processus s’inverse: la pression d’oxygène artériel augmente jusqu’à sa valeur au niveau de la mer et la ventilation diminue. La quantité de CO2 expirée est moins élevée et la pression de CO2 augmente dans le sang et dans le centre respiratoire. L’équilibre acido-basique est modifié dans le sens de l’acidité et les reins doivent retenir les bicarbonates pour rétablir l’équilibre. On a moins d’informations sur le temps requis pour la perte de l’acclimatement, mais il semble qu’il soit du même ordre de grandeur que pour le processus d’acclimatement. Le retour d’un séjour en altitude serait alors une image miroir de la montée en altitude, avec toutefois une exception importante: les pressions d’oxygène artériel redeviennent immédiatement normales à la descente.
Comme on peut l’imaginer, la situation varie selon les individus, tant en ce qui concerne le délai nécessaire à un acclimatement ventilatoire à une altitude donnée que l’importance de cet acclimatement. Cette variation s’explique en grande partie par la très grande diversité de la réponse ventilatoire à l’hypoxie selon les individus. Ainsi, au niveau de la mer, en maintenant la pression de CO2 constante, afin qu’elle n’interfère pas avec la réponse ventilatoire aux faibles concentrations d’oxygène, certaines personnes normales montrent uniquement une faible augmentation de la ventilation, voire aucune augmentation du tout, alors que d’autres accusent une très forte augmentation (jusqu’à cinq fois plus). La réponse ventilatoire à la respiration de mélanges pauvres en oxygène semble être innée, puisque les similitudes du comportement sont plus grandes entre les membres d’une même famille que par rapport aux étrangers à celle-ci. Comme on pouvait s’y attendre, les personnes qui présentent de faibles réponses ventilatoires aux basses concentrations d’oxygène au niveau de la mer semblent avoir aussi de plus faibles réponses ventilatoires sur une période donnée à haute altitude. Il peut exister d’autres facteurs de la variabilité individuelle de l’adaptation, comme la variabilité de l’amplitude de la dépression ventilatoire, du fonctionnement du centre respiratoire, de la sensibilité aux variations acido-basiques et du traitement des carbonates par les reins, mais ces facteurs n’ont pas été évalués jusqu’ici.
La mauvaise qualité du sommeil, en particulier avant l’acclimatement ventilatoire, est non seulement un sujet fréquent de plainte, mais aussi un facteur qui altère la performance. De nombreux paramètres tels que les émotions, l’activité physique, l’alimentation et le niveau de vigilance peuvent nuire à la fonction respiratoire. La ventilation décroît pendant le sommeil; il en va de même de la stimulation que de faibles concentrations en oxygène ou des concentrations élevées en CO2 exercent sur la respiration tandis que la fréquence et l’amplitude respiratoires augmentent. En outre, aux grandes altitudes, où l’air comporte un moins grand nombre de molécules d’oxygène, la quantité d’oxygène emmagasinée dans les alvéoles pulmonaires entre deux inspirations est moins élevée. Par conséquent, si la respiration cesse pendant quelques secondes (un phénomène appelé apnée, fréquent à haute altitude), la pression d’oxygène artériel diminue plus rapidement qu’au niveau de la mer, où la réserve d’oxygène est par essence plus élevée.
Les interruptions périodiques de la respiration sont un mécanisme quasi universel dans les premières nuits qui suivent une montée à haute altitude. C’est le reflet du dilemme respiratoire de l’altitude décrit précédemment, qui a un caractère cyclique: la stimulation hypoxique augmente la ventilation, qui diminue à son tour la teneur en CO2, inhibe la respiration et augmente la stimulation hypoxique, ce qui stimule à nouveau la ventilation. Il existe habituellement une période d’apnée de 15 à 30 secondes, suivie de plusieurs respirations très larges qui ont souvent pour effet de réveiller brièvement le sujet, puis une nouvelle apnée. Les périodes d’apnée abaissent parfois la pression d’oxygène artériel jusqu’à des niveaux alarmants. Les réveils peuvent être fréquents et, même lorsque la durée totale du sommeil est normale, sa fragmentation en altère la qualité au point que le sujet a l’impression d’avoir passé une nuit sans détente ou même sans sommeil. L’administration d’oxygène élimine le caractère cyclique de la stimulation hypoxique et l’inhibition alcalosique supprime la respiration périodique et rétablit un sommeil normal.
Les hommes d’âge moyen, en particulier, sont exposés en raison d’une autre cause de l’apnée, à savoir une obstruction intermittente des voies aériennes qui est le plus fréquemment à l’origine du ronflement. Au niveau de la mer, une obstruction intermittente à l’arrière des voies nasales ne provoque ordinairement qu’un bruit désagréable, mais aux altitudes élevées, où la réserve d’oxygène des poumons est plus faible, cette obstruction peut se traduire par des niveaux de pression d’oxygène artériel extrêmement bas et par un sommeil de mauvaise qualité.
Il existe des activités professionnelles, notamment dans la cordillère des Andes, qui obligent les travailleurs à passer en alternance plusieurs jours à des altitudes au-delà de 3 000 à 4 000 m suivis de plusieurs jours chez eux au niveau de la mer. Les horaires de travail (nombre de jours en altitude, par exemple de 4 à 14 jours, et nombre de jours au niveau de la mer, par exemple de 3 à 7) sont généralement dictés par des facteurs économiques plutôt que par des considérations de santé. Le temps requis à la fois pour l’adaptation et pour la perte d’adaptation à l’altitude représente cependant un facteur à considérer sur le plan économique. Une attention particulière devrait être accordée au sentiment de bien-être du travailleur et à ses performances sur le lieu de travail, à son arrivée et dans les 2 jours qui suivent, en ce qui concerne notamment la fatigue, le temps nécessaire pour exécuter des tâches courantes ou non, et les erreurs commises. On devrait également chercher à réduire le plus possible le temps nécessaire à l’adaptation à l’altitude et à améliorer l’activité pendant les heures de veille.
Les principaux effets de la haute altitude sur les êtres humains ont un rapport avec les changements de la pression barométrique (PB) et les variations concomitantes de la pression d’oxygène (O2) dans l’air ambiant. La pression barométrique diminue lorsque l’altitude augmente et elle peut être estimée au moyen de l’équation suivante:
où a est l’altitude exprimée en mètres. En fait, la relation entre la pression barométrique et l’altitude est également influencée par d’autres facteurs comme la distance de l’équateur et la saison. West et Lahiri (1984) ont constaté que les mesures directes de la pression barométrique au voisinage de l’équateur et au sommet de l’Everest (8 848 m) donnaient des valeurs supérieures aux prédictions fondées sur l’atmosphère standard de l’Organisation de l’aviation civile internationale (OACI). Les conditions atmosphériques et la température affectent elles aussi la relation entre la pression barométrique et l’altitude, dans la mesure où un système atmosphérique de basse pression peut réduire la pression, avec pour résultat que les personnes séjournant en haute altitude se trouvent «physiologiquement» à des altitudes encore plus élevées. Comme la pression partielle de l’oxygène inspiré (Po2) reste constamment égale à 20,93% environ de la pression barométrique, le principal déterminant de la Po2 dans l’air inspiré à une altitude quelconque est la pression barométrique. L’oxygène inspiré diminue donc lorsque l’altitude augmente en raison de la diminution de la pression barométrique, comme le montre la figure 37.5.
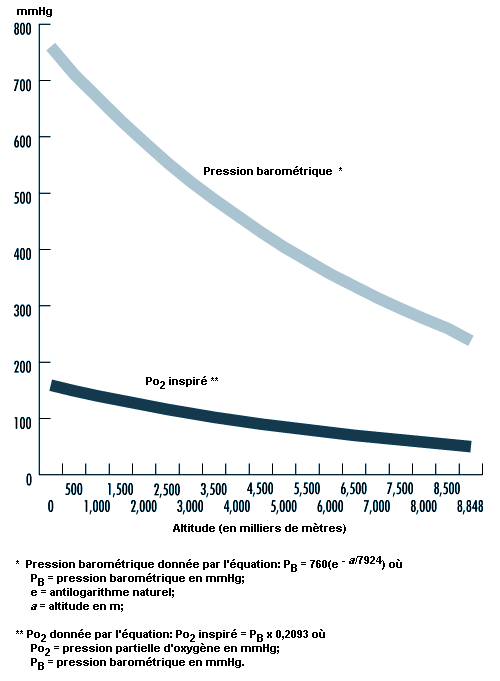
La température et le rayonnement ultraviolet changent également aux altitudes élevées: la température décroît lorsque l’altitude augmente, à raison d’environ 6,5 °C par 1 000 m, alors que le rayonnement ultraviolet augmente d’environ 4% par 300 m en raison de la raréfaction des nuages, du brouillard et de la vapeur d’eau. En outre, jusqu’à 75% du rayonnement ultraviolet peut être reflété par la neige, ce qui accroît encore son action à haute altitude. La survie dans ces environnements dépend dès lors de l’adaptation à chacun de ces éléments et des mesures de protection prises à leur encontre.
Si les montées rapides jusqu’à des altitudes élevées peuvent souvent entraîner la mort, les montées lentes telles que les pratiquent les montagnards peuvent être envisagées favorablement lorsqu’elles s’accompagnent de mesures physiologiques compensatoires. L’adaptation aux altitudes élevées vise à maintenir un approvisionnement suffisant en oxygène pour répondre aux demandes métaboliques malgré la diminution de la Po2 dans l’air inspiré. La réalisation de cet objectif nécessite des modifications dans tous les systèmes organiques participant à l’absorption de l’oxygène dans le corps, à sa distribution aux organes qu’il alimente et à son transfert dans les tissus.
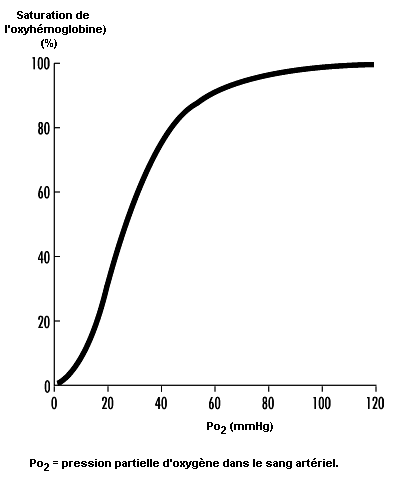
L’étude du processus d’absorption et de distribution de l’oxygène nécessite une connaissance des facteurs qui déterminent la teneur du sang en oxygène. Lorsque l’air pénètre dans les alvéoles, la Po2 de l’air inspiré diminue jusqu’à un nouveau niveau (appelé Po2 alvéolaire) sous l’effet de deux facteurs: l’augmentation de la pression partielle de la vapeur d’eau par suite de l’humidification de l’air inspiré et l’augmentation de la pression partielle du dioxyde de carbone (Pco2) du fait de l’évacuation du CO2. A partir des alvéoles, l’oxygène diffuse à travers la membrane alvéolo-capillaire pour parvenir jusqu’au sang en raison de l’existence d’un gradient entre la Po2 alvéolaire et la Po2 dans le sang. L’essentiel de l’oxygène présent dans le sang se fixe sur l’hémoglobine (oxyhémoglobine). La teneur en oxygène est donc directement liée à la fois à la concentration d’hémoglobine dans le sang et au pourcentage de sites de fixation de l’oxygène sur l’hémoglobine qui sont saturés en oxygène (saturation de l’oxyhémoglobine). Il est donc essentiel de comprendre la relation entre la Po2 du sang artériel et la saturation de l’oxyhémoglobine pour comprendre quels sont les éléments qui déterminent la teneur du sang en oxygène. La figure 37.6 illustre la courbe de dissociation de l’oxyhémoglobine. Lorsque l’altitude augmente, la Po2 dans l’air inspiré diminue; par conséquent, la Po2 du sang artériel ainsi que la saturation de l’oxyhémoglobine diminuent également. Chez les sujets normaux, les altitudes supérieures à 3 000 m sont associées à une diminution de la Po2 du sang artériel suffisante pour que la saturation de l’oxyhémoglobine tombe au-dessous de 90%, sur la portion à forte pente de la courbe de dissociation de l’oxyhémoglobine; on peut prévoir que lorsqu’on s’élèvera encore en altitude, il en résultera une désaturation sensible en l’absence de mécanismes compensatoires.
Les adaptations ventilatoires qui se produisent à haute altitude protègent la pression partielle d’oxygène dans le sang artériel contre les effets d’une diminution des niveaux d’oxygène ambiants et peuvent être réparties en variations aiguës, subaiguës et chroniques. Une montée très rapide jusqu’à des altitudes élevées produit une diminution de la Po2 dans l’air inspiré qui entraîne à son tour une diminution de la Po2 dans le sang artériel (hypoxie). Pour réduire au minimum les effets de la diminution de la Po2 dans l’air inspiré sur la saturation de l’oxyhémoglobine artérielle, l’hypoxie qui se produit à haute altitude déclenche un accroissement de la ventilation par l’intermédiaire du corpuscule carotidien (réponse ventilatoire hypoxique). L’hyperventilation accroît l’évacuation du dioxyde de carbone, ce qui provoque une diminution de la pression partielle de dioxyde de carbone (Pco2) dans le sang artériel, puis dans l’alvéole pulmonaire. La diminution de la Pco2 alvéolaire permet une augmentation de la Po2 alvéolaire et, par voie de conséquence, de la Po2 et de la concentration en O2 dans le sang artériel. L’augmentation de l’élimination du dioxyde de carbone provoque cependant aussi une diminution de la concentration des ions hydrogène ([H+]) dans le sang qui conduit à l’apparition d’une alcalose; celle-ci inhibe la réponse ventilatoire hypoxique. C’est ainsi que lors d’une montée rapide à haute altitude, il y a un brusque accroissement de la ventilation modulé par l’apparition d’une alcalose dans le sang.
Dans les jours qui suivent la montée en altitude, il se produit de nouveaux changements de la ventilation, appelés communément acclimatement ventilatoire. La ventilation continue d’augmenter dans les semaines qui suivent. Ce nouvel accroissement de la ventilation s’accompagne d’une compensation de l’alcalose aiguë par les reins sous la forme d’une élimination d’ions bicarbonate, laquelle augmente à son tour la concentration d’ions [H+] dans le sang. On pensait initialement que la compensation rénale de l’alcalose supprimait l’effet inhibiteur de cette alcalose sur la réponse ventilatoire hypoxique, ce qui permettrait à celle-ci de développer tout son potentiel. Les mesures du pH sanguin ont cependant révélé que l’alcalose persiste malgré l’accroissement de la ventilation. Parmi les autres mécanismes possibles, on peut envisager: 1) un retour à la normale du pH du liquide céphalo-rachidien entourant le centre respiratoire dans la moelle malgré la persistance d’une alcalose sérique; 2) une sensibilité accrue du corpuscule carotidien à l’hypoxie; 3) une réponse accrue du mécanisme de contrôle respiratoire au CO2. Lorsque l’acclimatement ventilatoire s’est produit, l’hyperventilation et la réponse ventilatoire hypoxique persistent pendant plusieurs jours après le retour à des altitudes plus basses, et cela malgré la disparition de l’hypoxie.
De nouveaux changements ventilatoires apparaissent après plusieurs années passées à haute altitude. Les mesures sur des personnes nées à ces altitudes ont montré une baisse de la réponse ventilatoire hypoxique par rapport aux valeurs obtenues pour les sujets acclimatés, sans qu’on revienne pour autant aux valeurs observées chez les sujets vivant au niveau de la mer. Le méca-nisme de la diminution de la réponse ventilatoire hypoxique est inconnu, mais il pourrait être lié à une hypertrophie du corpuscule carotidien ou au développement d’autres mécanismes d’adaptation en vue de préserver l’oxygénation des tissus, comme un accroissement de la densité capillaire, de la capacité d’échanges gazeux des tissus, du nombre et de la densité des mitochondries ou de la capacité vitale.
Outre son effet sur la ventilation, l’hypoxie provoque également une constriction du muscle lisse vasculaire dans les artères pulmonaires (vasoconstriction hypoxique). L’augmentation de la résistance du système vasculaire pulmonaire et de la pression artérielle pulmonaire qui s’ensuit éloigne le sang des alvéoles hypoventilées à faible Po2 alvéolaire pour le diriger vers les alvéoles mieux ventilées. La perfusion artérielle pulmonaire est ainsi adaptée aux éléments des poumons qui sont bien ventilés, ce qui fournit un nouveau moyen de préserver la Po2 du sang artériel.
L’apport d’oxygène aux tissus est également amélioré par l’adaptation des systèmes cardio-vasculaire et hématologique. A la première montée en haute altitude, la fréquence cardiaque augmente, ce qui entraîne une augmentation du débit cardiaque. Sur une période de plusieurs jours, le débit cardiaque s’abaisse en raison d’une diminution du volume de plasma causée par les pertes d’eau accrues qui se produisent aux altitudes élevées. Par la suite, l’accroissement de la production d’érythropoïétine conduit à une élévation de la concentration d’hémoglobine qui améliore la capacité de transport d’oxygène par le sang. Le maintien de l’oxygénation des tissus peut être favorisé non seulement par l’accroissement des niveaux d’hémoglobine, mais aussi par des changements dans l’affinité de l’oxygène pour l’hémoglobine. On pourrait s’attendre à un décalage vers la droite de la courbe de dissociation de l’oxyhémoglobine parce qu’un tel décalage favori-serait les dégagements d’oxygène dans les tissus. Les données recueillies au sommet de l’Everest et dans des expériences en chambre hyperbare simulant cette altitude suggèrent cependant que la courbe est décalée vers la gauche (West et Lahiri, 1984; West et Wagner, 1980; West, Boyer, Graber et coll., 1983). Un décalage vers la gauche signifierait que les dégagements d’oxygène dans les tissus sont rendus plus difficiles, mais cela pourrait néanmoins être avantageux aux altitudes extrêmes, car l’absorption d’oxygène par les poumons serait facilitée malgré une très forte réduction de la Po2 dans l’air inspiré (43 mmHg au sommet de l’Everest et 149 mmHg au niveau de la mer).
Le dernier maillon de la chaîne de l’approvisionnement des tissus en oxygène est constitué par l’absorption et l’utilisation de l’oxygène au niveau cellulaire. D’un point de vue théorique, deux adaptations sont possibles. Premièrement, la distance à parcourir par l’oxygène pour diffuser à l’extérieur du vaisseau sanguin vers le site intracellulaire responsable du métabolisme oxydatif, les mitochondries, peut être réduite au minimum. Deuxièmement, il peut se produire des transformations biochimiques qui améliorent la fonction mitochondriale. La réduction au minimum de la distance de diffusion a été suggérée par des études qui montrent soit une augmentation de la densité capillaire, soit une augmentation de la densité mitochondriale dans les tissus musculaires. On ne sait pas si ces changements reflètent un recrutement ou un développement des capillaires et des mitochondries, ou s’il s’agit d’un artefact dû à une atrophie musculaire. Dans chacun des deux cas, la distance entre les capillaires et les mitochondries diminuerait, ce qui faciliterait la diffusion de l’oxygène. L’accroissement des concentrations de myoglobine est l’une des transformations biochimiques susceptibles d’améliorer la fonction mitochondriale. La myoglobine est une protéine intracellulaire qui fixe l’oxygène aux faibles valeurs de la Po2 dans les tissus et qui facilite la diffusion de l’oxygène dans les mitochondries. La concentration de myoglobine augmente avec l’entraînement et présente une corrélation avec la capacité de travail aérobique des cellules musculaires. Ces adaptations sont théoriquement bénéfiques, mais on manque de preuves décisives à cet égard.
Les descriptions rapportées par les premiers explorateurs de la montagne font état de changements dans les fonctions cérébrales. On a décrit une diminution des facultés motrices, sensorielles et cognitives, y compris une diminution de l’aptitude à apprendre de nouvelles tâches et une difficulté à présenter verbalement des informations. Ces déficits peuvent altérer le jugement et conduire à une irritabilité, ce qui est de nature à aggraver les problèmes rencontrés aux altitudes élevées. Après le retour en plaine, ces déficits s’atténuent au terme d’une période variable; on a constaté des troubles de la mémoire et de la concentration persistant de plusieurs jours à plusieurs mois, ainsi qu’une chute de la vitesse de dactylographie pendant une période d’un an (Hornbein et coll., 1989). Les individus présentant une réponse ventilatoire hypoxique plus élevée sont davantage sujets aux déficits de longue durée, peut-être parce que l’effet bénéfique de l’hyperventilation sur la saturation de l’oxyhémoglobine artérielle est compensé par une hypocapnie (diminution de la Pco2 dans le sang) qui entraîne une constriction des vaisseaux sanguins cérébraux conduisant à une diminution du débit sanguin cérébral.
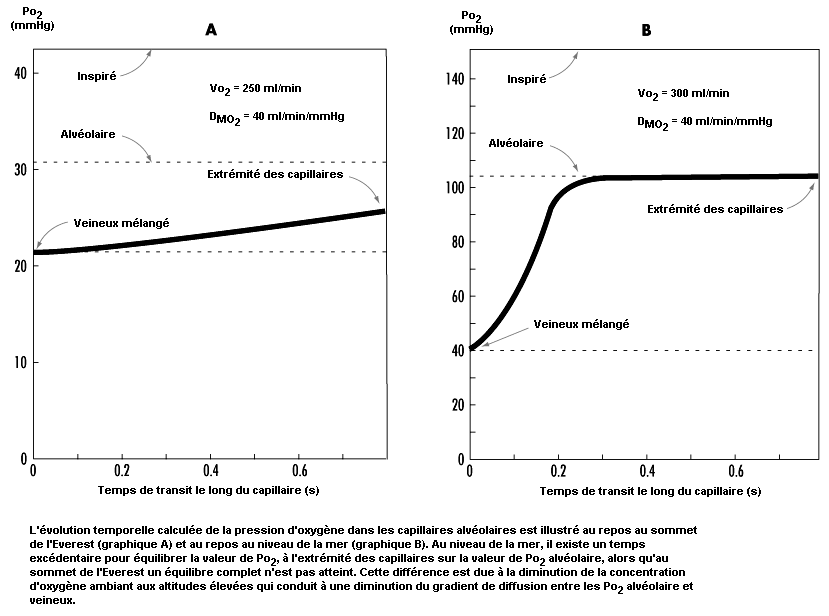
Les observations qui précèdent concernent exclusivement les conditions au repos; l’exercice constitue un élément de perturbation supplémentaire, étant donné qu’il accroît la demande et la consommation d’oxygène. La raréfaction de l’oxygène ambiant à haute altitude provoque une diminution de l’absorption maximale d’oxygène et donc de l’effort maximal possible. En outre, la diminution de la Po2 dans l’air inspiré affecte gravement la diffusion de l’oxygène dans le sang. C’est ce qui ressort de la figure 37.7, qui montre le temps de diffusion de l’oxygène dans les capillaires alvéolaires. Au niveau de la mer, il existe un temps excédentaire pour équilibrer la valeur de la Po2 à l’extrémité des capillaires et celle de la Po2 alvéolaire, alors qu’au sommet de l’Everest un équilibre complet n’est pas atteint. La différence s’explique par une diminution du niveau d’oxygène ambiant en altitude qui conduit à une réduction du gradient de diffusion entre les Po2 alvéolaire et veineuse. Avec l’effort, le débit cardiaque et le débit sanguin augmentent, ce qui réduit le temps de transit des cellules sanguines à travers les capillaires alvéolaires et contribue à aggraver le problème. Il ressort de cet exposé que le décalage vers la gauche de la courbe de dissociation de l’oxygène et de l’hémoglobine en fonction de l’altitude est nécessaire en tant que compensation de la réduction du gradient de diffusion de l’oxygène dans les alvéoles.
Les troubles du sommeil sont fréquents lors des séjours à haute altitude. La respiration périodique (respiration de Cheyne-Stokes) est un phénomène universel, caractérisé par des périodes d’exagération du rythme respiratoire (hyperpnée) alternant avec des périodes d’absence de respiration (apnée) conduisant à une hypoxie. La respiration périodique a donc tendance à être plus prononcée chez les personnes présentant une sensibilité ventilatoire hypoxique maximale, et moins prononcée chez les personnes séjournant en altitude et présentant une réponse ventilatoire hypoxique plus faible. On observe cependant des périodes d’hypoventilation prolongées, correspondant à des diminutions prolongées de la saturation de l’oxyhémoglobine. Le mécanisme de la respiration périodique est probablement lié à un accroissement de la réponse ventilatoire hypoxique qui provoque une hyperventilation en réponse à l’hypoxie. Cette hyperventilation conduit à un accroissement du pH sanguin (alcalose) qui supprime à son tour la ventilation. A mesure que l’acclimatement progresse, la respiration périodique s’améliore. Le traitement par l’acétazolamide diminue la respiration périodique et améliore la saturation de l’oxyhémoglobine artérielle pendant le sommeil. On devrait utiliser avec précaution les médicaments qui réduisent la ventilation, de même que l’alcool, car il pourrait en résulter une aggravation de l’hypoxie observée pendant le sommeil.
L’adaptation physiologique de l’humain aux altitudes élevées est un phénomène complexe susceptible, de ce fait, de recevoir un grand nombre de réponses potentiellement inadaptées. Bien que chaque syndrome soit décrit séparément dans les paragraphes qui suivent, ils se recouvrent dans une très large mesure. Les maladies telles que l’hypoxie aiguë, le mal des montagnes (ou mal d’altitude) aigu, l’œdème pulmonaire d’altitude et l’œdème cérébral d’altitude représentent très vraisemblablement un éventail d’ano-malies correspondant à des physiopathologies similaires.
L’hypoxie survient lors des montées à haute altitude en raison de la baisse de la pression barométrique et de la diminution corres-pondante de l’oxygène ambiant. Lorsque l’ascension est rapide, l’hypoxie prend une forme aiguë et l’organisme n’a pas le temps de s’adapter. Les alpinistes sont généralement protégés contre les effets de l’hypoxie aiguë en raison du temps nécessaire aux montées en altitude et donc de l’acclimatement qui se produit. L’hypoxie aiguë concerne également les aviateurs et le personnel des services de secours opérant à haute altitude. La très forte désaturation de l’oxyhémoglobine (jusqu’à des valeurs inférieures à 40 à 60%) conduit à une perte de conscience. Lorsque cette désaturation est moins prononcée, les personnes éprouvent des maux de tête, de la confusion, de la somnolence et une perte de la coordination. L’hypoxie suscite également un état d’euphorie que Tissandier, lors de son ascension en ballon en 1875, a décrit comme une «jubilation intérieure». A un niveau encore plus grave, la désaturation entraîne la mort. L’hypoxie aiguë réagit rapidement et complètement à l’administration d’oxygène ou au retour à une altitude plus basse.
Le mal aigu des montagnes, qui est le trouble le plus fréquent à haute altitude, touche jusqu’aux deux tiers des personnes qui se rendent en montagne. L’incidence de cette pathologie dépend de multiples facteurs, notamment de la rapidité de l’ascension, de la durée de l’exposition, du degré d’activité et de la sensibilité individuelle. L’identification des individus affectés est importante afin d’éviter une progression vers un œdème pulmonaire ou cérébral; elle s’opère par la reconnaissance des signes et symptômes caractéristiques. La plupart du temps, le mal aigu des montagnes apparaît dans les heures qui suivent une ascension rapide à des altitudes supérieures à 2 500 m. Les symptômes les plus courants sont les maux de tête, plus prononcés la nuit, une perte d’appétit pouvant s’accompagner de nausées et de vomissements, des troubles du sommeil et de la fatigue. Les personnes atteintes se plaignent fréquemment d’essoufflement, de toux et de symptômes neurologiques, comme des pertes de mémoire et des troubles auditifs ou visuels. L’examen physique peut parfois ne rien révéler, quoique la rétention de liquides puisse être un signe annonciateur. La pathogenèse du mal aigu des montagnes est peut-être liée à une hypoventilation relative qui augmenterait le débit sanguin cérébral et la pression intracrânienne par une augmentation de Pco2 et une diminution de Po2 dans les artères. Ce mécanisme pourrait expliquer pourquoi le mal aigu des montagnes est moins fréquent chez les personnes présentant une importante réponse ventilatoire hypoxique. Le mécanisme de la rétention des liquides n’est pas encore bien compris, mais il pourrait être lié à des concentrations plasmatiques anormales de protéines ou d’hormones régulatrices de l’évacuation de l’eau par les reins; il est possible que ces régulateurs répondent à un accroissement de l’activité du système nerveux sympathique noté chez les personnes atteintes d’un mal aigu des montagnes. L’accumulation d’eau peut à son tour conduire à l’apparition d’un œdème ou d’un gonflement des espaces interstitiels des poumons. Dans les cas les plus graves, un œdème pulmonaire ou cérébral peut apparaître.
Le mal aigu des montagnes peut être prévenu par une montée lente, par étapes, laissant un temps suffisant pour l’adaptation. Cette manière de procéder peut être particulièrement importante pour les sujets présentant une plus grande susceptibilité ou des antécédents de mal aigu des montagnes. L’administration d’acétazolamide avant ou pendant la montée peut aussi contribuer à prévenir l’apparition des symptômes ou apporter une amélioration. L’acétazolamide inhibe l’action de l’anhydrase carbonique dans les reins et augmente l’excrétion des ions bicarbonates et de l’eau, ce qui produit une acidose dans le sang. Cette acidose stimule la respiration, qui a pour effet d’accroître la saturation de l’oxyhémoglobine artérielle et de diminuer la respiration périodique pendant le sommeil. Par ce mécanisme, l’acétazolamide accélère le processus naturel de l’acclimatement.
Le retour en plaine est la manière la plus efficace de traiter le mal aigu des montagnes. Toute nouvelle montée en altitude est contre-indiquée, car elle pourrait faire progresser la maladie. Lorsque la descente est impossible, on peut administrer de l’oxygène. Dans les expéditions en haute montagne, on peut également emporter des chambres hyperbares portables en tissu léger. Les sacs hyperbares sont particulièrement utiles lorsqu’on ne dispose pas d’oxygène et que la descente est impossible. Il existe plusieurs médicaments qui atténuent les symptômes du mal aigu des montagnes, notamment l’acétazolamide et la dexaméthasone. Le mécanisme de l’action de la dexaméthasone n’est pas bien connu, mais il pourrait agir en diminuant les risques de formation d’œdème.
L’œdème pulmonaire d’altitude affecte environ 0,5 à 2,0% des personnes qui montent à des altitudes supérieures à 2 700 m, et il est la cause la plus fréquente des décès dus aux maladies qui surviennent en montagne. L’œdème pulmonaire d’altitude apparaît dans un délai de 6 à 96 heures après la montée. Les facteurs de risque pour l’apparition de cette maladie sont semblables à ceux du mal aigu des montagnes. Les premiers signes les plus courants sont des symptômes du mal aigu des montagnes accompagnés d’une diminution de la tolérance à l’effort, d’une augmentation du temps de récupération après effort, d’une dyspnée à l’effort et d’une toux sèche persistante. A mesure que l’état s’aggrave, le patient présente une dyspnée au repos, une congestion à l’auscultation des poumons et une cyanose des lits unguéaux et des lèvres. La pathogenèse de ces troubles est incertaine, mais elle est probablement liée à un accroissement de la pression microvasculaire ou à une augmentation de la perméabilité du système microvasculaire conduisant à l’apparition de l’œdème pulmonaire. Bien que l’hypertension pulmonaire puisse aider à expliquer la pathogenèse, une élévation de la pression artérielle pulmonaire due à l’hypoxie a été observée chez toutes les personnes qui montent en altitude, y compris celles qui ne développent pas d’œdème pulmonaire. Les sujets sensibles peuvent néanmoins présenter une constriction hypoxique anormale des artères pulmonaires conduisant à une surperfusion du système microvasculaire dans des zones localisées où une vasoconstriction hypoxique était absente ou diminuée. L’élévation de pression et les forces de cisaillement qui en résultent peuvent endommager la membrane capillaire et conduire à la formation d’un œdème. Ce mécanisme explique la dispersion de cette maladie et son aspect à l’examen radiographique pulmonaire. Comme pour le mal aigu des montagnes, les individus présentant une réponse ventilatoire hypoxique plus faible sont davantage susceptibles de développer un œdème pulmonaire d’altitude, puisqu’ils ont de plus faibles saturations d’oxyhémoglobine et donc une plus grande vasoconstriction pulmonaire hypoxique.
La prévention de l’œdème pulmonaire d’altitude est semblable à celle du mal aigu des montagnes: elle comprend la montée progressive et la prise d’acétazolamide. On a montré récemment que l’administration de nifédipine, un agent relaxant des muscles lisses, exerce une action préventive chez les personnes ayant des antécédents d’œdème pulmonaire d’altitude. Le fait d’éviter les efforts peut également avoir un rôle préventif, bien que cela se limite probablement aux personnes présentant déjà la maladie à un degré infraclinique.
Le meilleur moyen de traiter l’œdème pulmonaire d’altitude est de procéder à une évacuation assistée à plus basse altitude en tenant compte du fait que la victime doit limiter son activité physique. Après la descente, l’amélioration est rapide et aucun traitement supplémentaire autre que le repos allongé et l’adminis-tration d’oxygène n’est ordinairement nécessaire. Lorsque la descente n’est pas possible, l’oxygénothérapie peut être utile. Des médications ont été tentées avec de très nombreux agents, les plus efficaces étant un diurétique, le furosémide, et la morphine. Ces médicaments doivent être employés avec précaution, car ils peuvent provoquer une déshydratation, une diminution de la pression sanguine et une dépression respiratoire. Malgré l’efficacité du retour en plaine en tant que thérapie, la mortalité demeure au niveau de 11% environ. Ce taux élevé tient vraisemblablement au fait que la maladie n’a pas été diagnostiquée à temps ou qu’il n’a pas été possible de redescendre le malade, sans pouvoir pour autant lui administrer d’autres traitements.
L’œdème cérébral d’altitude représente une forme extrême du mal aigu des montagnes ayant progressé jusqu’à inclure un dysfonctionnement cérébral généralisé. Son incidence est mal connue, car il est difficile de différencier un cas grave de mal aigu des montagnes d’un cas atténué d’œdème cérébral. La pathogenèse de l’œdème cérébral d’altitude est une extension de celle du mal aigu des montagnes; l’hypoventilation accroît le débit sanguin cérébral et la pression intracrânienne jusqu’à l’apparition d’un œdème. Les premiers symptômes d’un œdème cérébral sont identiques à ceux d’un mal aigu des montagnes. A mesure que la maladie progresse, on note des symptômes neurologiques supplémentaires, comme une forte irritabilité et de l’insomnie, une ataxie, des hallucinations, une paralysie, des crises épileptiques et, pour finir, un coma. L’examen des yeux révèle communément un gonflement de la papille optique, ou œdème papillaire. Les hé-morragies rétiniennes sont fréquentes. Par ailleurs, les œdèmes cérébraux sont souvent associés à des œdèmes pulmonaires.
Le traitement de l’œdème cérébral d’altitude est semblable à celui des autres troubles dus aux altitudes élevées, la descente en plaine étant la thérapie préférée. Il est indiqué d’administrer de l’oxygène pour maintenir une saturation de l’oxyhémoglobine supérieure à 90%. La constitution de l’œdème peut être atténuée par l’utilisation de corticostéroïdes comme la dexaméthasone. Des diurétiques ont également été employés pour diminuer l’œdème, mais leur efficacité est incertaine. Les patients comateux peuvent avoir besoin d’une assistance supplémentaire au niveau des voies aériennes. La réponse au traitement est variable, avec des déficits neurologiques et un coma persistant sur une période de plusieurs jours à plusieurs semaines après l’évacuation à plus basse altitude. Les mesures préventives de l’œdème cérébral sont identiques à celles des autres syndromes d’altitude.
Les hémorragies rétiniennes sont extrêmement fréquentes, puis-qu’elles affectent jusqu’à 40% des individus à 3 700 m et 56% à 5 350 m. Elles sont ordinairement asymptomatiques et sont très probablement causées par un accroissement du débit sanguin et une dilatation vasculaire de la rétine dus à une hypoxie artérielle. Les hémorragies rétiniennes sont plus fréquentes chez les individus sujets aux céphalées; elles peuvent être précipitées par un effort physique intense. A la différence d’autres syndromes d’altitude, les hémorragies rétiniennes ne peuvent pas être prévenues par une thérapie à base d’acétazolamide ou de furosémide. Elles disparaissent généralement de manière spontanée en deux semaines.
Le mal chronique des montagnes affecte les personnes résidant en permanence, ou installées depuis longtemps, à haute altitude. La première description en a été donnée par Monge qui étudiait des Indiens des Andes vivant à des altitudes supérieures à 4 000 m. Le mal chronique des montagnes, ou maladie de Monge, a été décrit depuis lors chez la plupart des habitants des régions montagneuses, à l’exception des sherpas. Les hommes sont plus fréquemment affectés que les femmes. Le mal se caractérise par une pléthore, une cyanose et une augmentation du nombre des globules rouges conduisant à des symptômes neurologiques incluant les maux de tête, les vertiges, la léthargie et les troubles de la mémoire. Les victimes de ce mal peuvent être atteintes d’une défaillance du cœur droit, appelée également cœur pulmonaire , due à une hypertension pulmonaire et à une forte réduction de la saturation de l’oxyhémoglobine. La pathogenèse du mal chronique des montagnes n’est pas bien établie. Des mesures sur les individus affectés ont révélé une diminution de la réponse ventilatoire hypoxique, une grave hypoxémie exacerbée pendant le sommeil, ainsi qu’une augmentation de la concentration en hémoglobine et de la pression artérielle pulmonaire. Bien qu’une relation de cause à effet semble probable, les preuves sont absentes ou manquent de clarté.
Une bonne partie des symptômes du mal chronique des montagnes peut être améliorée par un retour au niveau de la mer qui supprime le stimulus hypoxique pour la production d’érythrocytes et la vasoconstriction pulmonaire. Les autres traitements envisa-geables sont la phlébotomie, pour réduire le nombre des globules rouges, et l’administration d’oxygène avec un faible débit pendant le sommeil, pour atténuer l’hypoxie. On a constaté également l’efficacité d’un traitement à la médroxyprogestérone, un stimulant respiratoire. Une étude relève que l’administration de mé-droxyprogestérone pendant 10 semaines a été suivie d’une amélioration de la ventilation, d’une atténuation de l’hypoxie et d’une diminution du nombre des globules rouges.
Les patients atteints d’anémie falciforme sont davantage sujets à des crises douloureuses d’occlusion vasculaire en altitude. Même à l’altitude modérée de 1 500 m, on a constaté que ces crises étaient précipitées; à 1 925 m, le risque de crise est de 60%. En Arabie saoudite, les personnes atteintes d’anémie falciforme et résidant à 3 050 m ont deux fois plus de crises que les patients au niveau de la mer. En outre, les sujets présentant un trait drépanocytaire peuvent développer un syndrome d’infarctus splénique lors d’une montée en altitude. Les étiologies probables pour l’accroissement du risque de crise d’occlusion vasculaire comprennent la déshydratation, l’augmentation du nombre des globules rouges et l’immobilité. On traite les crises d’occlusion vasculaire par un retour au niveau de la mer, une oxygénothérapie et une hydratation intraveineuse.
Il n’existe pratiquement pas de données sur les risques que présente une montée aux altitudes élevées pour les femmes enceintes. Bien que les patientes résidant en haute montagne présentent un risque accru d’hypertension due à la grossesse, il n’est pas fait état d’une augmentation du nombre d’avortements involontaires. L’hypoxie aiguë peut provoquer des anomalies de la fréquence cardiaque du fœtus, mais cela se produit uniquement à très haute altitude ou en présence d’un œdème pulmonaire d’altitude. Le risque majeur pour la femme enceinte paraît donc lié à l’éloignement plutôt qu’à des complications induites par l’altitude.
De nombreuses personnes travaillent à des altitudes élevées, en particulier dans les villes et les villages des Andes et sur le plateau tibétain. La majorité sont des montagnards installés depuis de nombreuses années, voire plusieurs générations. Il s’agit le plus souvent d’activités agricoles, comme la garde de troupeaux.
L’objet de ce chapitre est cependant différent. On a constaté récemment un important développement des activités industrielles à des altitudes allant de 3 500 à 6 000 m. C’est ainsi qu’au Chili et au Pérou des mines sont exploitées à des altitudes d’environ 4 500 m; certaines d’entre elles sont très importantes et emploient plus de 1 000 personnes. Un autre exemple est celui du télescope de Mauna Kea, à Hawaï, situé à une altitude de 4 200 m.
Il est de tradition que les mines des Andes en altitude, dont certaines datent de la période coloniale espagnole, soient exploitées par des indigènes implantés en montagne depuis plusieurs générations. Néanmoins, depuis peu, on fait davantage appel à des travailleurs originaires des plaines. Il existe plusieurs raisons à ce changement. L’une est que, dans ces régions éloignées, la population n’est pas assez nombreuse pour les besoins de l’exploitation minière. Une autre raison, tout aussi importante, est que l’automatisation croissante de l’exploitation minière exige un personnel qualifié pour conduire les grandes excavatrices, les chargeuses et les camions, qualifications que la main-d’œuvre locale ne possède pas toujours. Une troisième raison tient à l’économie du développement de ces mines. Alors qu’auparavant des villes entières étaient créées au voisinage de la mine pour loger les familles des travailleurs avec l’infrastructure nécessaire, comme les écoles ou les hôpitaux, on estime maintenant préférable que les familles vivent en plaine et que les travailleurs effectuent le déplacement jusqu’aux mines. Les raisons ne sont pas uniquement d’ordre économique; en effet, la qualité de la vie est moins bonne à 4 500 m qu’elle ne l’est plus bas (la croissance des enfants y est plus lente, par exemple). La décision de laisser les familles en plaine et de déplacer les travailleurs en altitude repose donc sur une base socio-économique solide.
Le déplacement d’une main-d’œuvre du niveau de la mer à des altitudes de l’ordre de 4 500 m pose un grand nombre de problèmes médicaux, dont une bonne part demeurent mal compris. Il est certain que, chez la plupart des personnes qui passent du niveau de la mer à une altitude de 4 500 m, on voit apparaître dans un premier temps certains des symptômes du mal aigu des montagnes. La tolérance à l’altitude s’améliore souvent après les 2 ou 3 premiers jours. Mais la forte hypoxie à ces altitudes présente plusieurs effets nocifs pour l’organisme; la capacité de travail maximale est réduite et les personnes se fatiguent plus rapidement. L’efficacité mentale est affectée elle aussi, et de nombreuses personnes estiment qu’elles ont davantage de difficulté à se concentrer. Le sommeil est souvent de mauvaise qualité, avec de fréquents réveils et une respiration périodique (la respiration croît et décroît 3 ou 4 fois par minute), de sorte que la Po2 dans le sang artériel tombe à des niveaux peu élevés après les périodes d’apnée ou de respiration réduite.
La tolérance à l’altitude varie largement selon les individus, et il est souvent très difficile de prévoir quels seront ceux qui présenteront une intolérance. Un nombre appréciable de ceux qui désireraient travailler à 4 500 m constatent qu’ils sont incapables de le faire ou que la qualité de la vie y est si médiocre qu’ils refusent de rester. Des questions telles que la sélection des travailleurs susceptibles de tolérer des altitudes élevées, ou l’organisation d’horaires faisant alterner travail en altitude et séjour au niveau de la mer, sont relativement nouvelles et encore mal connues.
En plus de l’examen d’embauche habituel, on devrait accorder une attention spéciale au système cardio-respiratoire, étant donné que le travail en altitude sollicite fortement les systèmes respiratoire et cardio-vasculaire. Des affections comme un début de bronchite chronique et l’asthme seront bien plus invalidantes à haute altitude, en raison des niveaux élevés de ventilation, et l’on devrait s’attacher spécialement à leur dépistage. Un gros fumeur présentant des symptômes de bronchite aura vraisemblablement des difficultés à tolérer les altitudes élevées. On devrait effectuer un examen spirométrique forcé en plus de l’examen thoracique habituel comprenant une radiographie du thorax. On effectuera si possible une épreuve d’effort, car l’altitude a pour effet d’exa-cerber une intolérance à l’effort.
Le système cardio-vasculaire devrait être examiné avec soin; on prévoira si possible un électrocardiogramme d’effort. On procédera également à des numérations globulaires, de manière à exclure les personnes présentant des niveaux inhabituels d’anémie ou de polyglobulie.
Par ailleurs, comme la vie à haute altitude a souvent pour effet d’accroître la tension psychologique, on devrait examiner soi-gneusement les antécédents des candidats de manière à exclure ceux qui auraient présenté par le passé des problèmes de comportement. Dans de nombreuses mines modernes d’altitude, la consommation d’alcool est interdite. Enfin, les problèmes gastro-intestinaux étant fréquents chez certaines personnes aux altitudes élevées, celles qui ont déjà souffert de dyspepsie pourraient avoir des difficultés à s’acclimater.
En plus de la recherche des personnes souffrant d’une maladie respiratoire ou cardiaque et qui risquent de rencontrer des difficultés à haute altitude, il serait très utile d’effectuer des tests pour sélectionner celles qui sont susceptibles de bien s’adapter à l’altitude. Malheureusement, on ne dispose pour l’instant que d’informations limitées sur les prédicteurs de la tolérance aux altitudes élevées, quoique d’importants travaux soient effectués dans ce domaine.
L’expérience professionnelle antérieure constitue probablement le meilleur prédicteur de la tolérance aux altitudes élevées. Si une personne a pu travailler pendant plusieurs semaines à 4 500 m sans problème appréciable, il est très probable qu’elle pourra le faire à nouveau. De même, celui qui a tenté de travailler en altitude et constaté qu’il ne pouvait pas le supporter aura très probablement la même difficulté la fois suivante. Dans la sélection du personnel, on devrait donc accorder une grande importance au bon déroulement d’une période d’emploi antérieure en altitude. Il va de soi que ce critère ne saurait être appliqué strictement, car personne ne pourrait alors être choisi pour un premier emploi en altitude.
L’amplitude de la réponse ventilatoire à l’hypoxie est un autre prédicteur possible. Cette réponse peut être mesurée au niveau de la mer en faisant respirer au candidat une faible concentration d’oxygène et en mesurant l’accroissement de la ventilation. Il semble que les personnes présentant une réponse ventilatoire hypoxique relativement faible tolèrent mal les altitudes élevées. Schoene (1982) a montré, par exemple, que 14 alpinistes présentaient des réponses ventilatoires hypoxiques sensiblement plus élevées que celles de 10 témoins. D’autres mesures faites lors de l’expédition médicale américaine de 1981 à l’Everest ont montré que la réponse ventilatoire hypoxique mesurée avant et pendant l’expédition présentait une bonne corrélation avec les performances à très haute altitude (Schoene, Lahiri, Hackett et coll., 1984). Masuyama, Kimura, Sugita et coll. (1986) ont indiqué que 5 alpinistes ayant atteint 8 000 m au Kanchenjunga présentaient une réponse ventilatoire hypoxique supérieure à celle de 5 autres alpinistes qui n’étaient pas parvenus à cette altitude.
Cette corrélation est cependant loin d’être universelle. Dans une étude prospective sur 128 personnes ayant effectué des ascensions jusqu’à des altitudes élevées, la mesure de la réponse ventilatoire hypoxique ne présentait pas de corrélation positive avec l’altitude atteinte, alors qu’une mesure de la consommation maximale d’oxygène au niveau de la mer était effectivement corrélée (Richalet, Kerome et Bersch, 1988). Cette étude donne également à penser que la réponse de la fréquence cardiaque à l’hypoxie aiguë pourrait être un prédicteur utile des performances à haute altitude. D’autres études, en revanche, ont montré une faible corrélation entre la réponse ventilatoire hypoxique et les perfor-mances à très haute altitude (Ward, Milledge et West, 1995).
L’inconvénient d’un grand nombre de ces études est que leurs résultats s’appliquent surtout à des altitudes très supérieures à celles considérées ici. Il existe également de nombreux exemples d’alpinistes qui présentent une réponse ventilatoire hypoxique moyenne et qui ont néanmoins de bonnes performances en altitude. Quoi qu’il en soit, une réponse ventilatoire hypoxique anormalement basse constitue probablement un facteur de risque pour la tolérance à des altitudes même relativement modérées (comme 4 500 m).
Un moyen de mesurer la réponse ventilatoire hypoxique au niveau de la mer consiste à soumettre le sujet à des réinspirations dans un sac rempli initialement de 24% d’oxygène et de 7% de dioxyde de carbone, le reste étant constitué d’azote. Pendant les réinspirations, la valeur de Pco2 est contrôlée et maintenue cons-tante au moyen d’une dérivation variable et d’un absorbeur du dioxyde de carbone. Les réinspirations peuvent être poursuivies jusqu’à ce que la Po2 dans l’air inspiré tombe à environ 40 mmHg (5,3 kPa). La saturation artérielle en oxygène est mesurée en continu au moyen d’un oxymètre par impulsions, et la courbe de la ventilation est établie en fonction de la saturation (Rebuck et Campbell, 1974). Une autre manière de mesurer la réponse ventilatoire hypoxique consiste à déterminer la pression inspiratoire pendant une courte période d’occlusion des voies aériennes alors que le sujet respire un mélange sous-oxygéné (Whitelaw, Derenne et Milic-Emili, 1975).
Un autre prédicteur possible de la tolérance aux altitudes élevées est constitué par la capacité de travail pendant une hypoxie aiguë au niveau de la mer. On considère en effet qu’une personne qui n’est pas en mesure de tolérer une hypoxie aiguë est davantage susceptible d’intolérance à l’hypoxie chronique, bien que les preuves en faveur ou à l’encontre de cette hypothèse fassent relativement défaut. Les physiologistes soviétiques ont retenu la tolérance à l’hypoxie aiguë comme l’un des critères pour la sélection des alpinistes de l’expédition soviétique réussie à l’Everest en 1982 (Gazenko, 1987). On doit noter par ailleurs que les changements qui se produisent pendant l’acclimatement sont si profonds qu’il ne serait pas étonnant que les performances pendant une hypoxie aiguë présentent une faible corrélation avec l’aptitude à travailler pendant une hypoxie chronique.
On peut également retenir comme prédicteur l’accroissement de la pression artérielle pulmonaire pendant une hypoxie aiguë au niveau de la mer. Cette mesure peut être effectuée rapidement de manière non invasive au moyen d’un examen Doppler. La principale justification de ce test est la corrélation connue entre le développement d’un œdème pulmonaire d’altitude et le degré de vasoconstriction pulmonaire hypoxique (Ward, Milledge et West, 1995). Cependant, comme l’œdème pulmonaire d’altitude est peu fréquent chez les personnes travaillant à 4 500 m, l’utilité pratique de ce test est incertaine.
Le seul moyen d’établir si ces tests de sélection des travailleurs ont une valeur pratique est de faire une étude prospective dans laquelle les résultats des tests effectués au niveau de la mer sont corrélés à une évaluation ultérieure de la tolérance aux altitudes élevées. Cela pose la question de la méthode de mesure de cette tolérance. On procède habituellement au moyen de questionnaires, comme le questionnaire de Lake Louise (Hackett et Oelz, 1992). Les questionnaires peuvent cependant se révéler peu fia-bles, car les travailleurs ont conscience que s’ils admettent une intolérance à l’altitude, ils risquent de perdre leur emploi. Il est exact qu’il existe des signes objectifs de l’intolérance à l’altitude, comme le fait de quitter son travail, les râles pulmonaires (en tant qu’indication d’un œdème pulmonaire infraclinique) ou une ataxie modérée indiquant un œdème cérébral d’altitude infraclinique. Ces signes ne seront cependant observés que chez les personnes présentant une grave intolérance à l’altitude; une étude prospective effectuée uniquement sur ces bases serait dès lors fort peu significative.
Il convient de souligner que la valeur de ces tests de la tolérance au travail à haute altitude n’a pas été établie. Toutefois, les conséquences économiques du recrutement d’un nombre substantiel de personnes qui se révéleraient incapables d’effectuer un travail satisfaisant en altitude sont telles qu’il serait particulièrement intéressant de disposer de prédicteurs utiles. Des études se poursuivent actuellement en vue de déterminer lesquels de ces prédicteurs sont fiables et se prêtent à une application pratique. Des mesures comme la réponse ventilatoire hypoxique à l’hypoxie ou la capacité de travail pendant une hypoxie aiguë au niveau de la mer ne présentent pas de difficulté particulière. Elles doivent cependant être effectuées par un laboratoire professionnel. Enfin, le coût de ces investigations ne se justifie que si les mesures en question ont une valeur prédictive notable.
Il convient de rappeler que le présent article examine les problèmes particuliers qui se posent lorsque des activités industrielles comme l’exploitation minière exigent que des personnes quittent leur famille installée au niveau de la mer pour travailler à des altitudes de l’ordre de 4 500 m. Ces difficultés ne se posent évidemment pas lorsque ces personnes vivent en permanence en altitude.
L’élaboration d’un programme optimal pour les déplacements entre la haute altitude et le niveau de la mer est une question délicate; les programmes qui ont été utilisés jusqu’à présent sont relativement dépourvus de base scientifique, car ils étaient fondés essentiellement sur des considérations sociales comme la durée maximale du séjour en altitude que les travailleurs étaient disposés à accepter sans revoir leur famille.
Le principal argument médical en faveur d’un séjour de plusieurs jours consécutifs passés en haute altitude est l’avantage apporté par l’acclimatement. Un grand nombre de personnes montrant des symptômes de mal aigu des montagnes après une montée en altitude ressentent une amélioration très sensible après 2 à 4 jours, ce qui signifie qu’un acclimatement rapide s’est produit pendant cette période. On sait par ailleurs que la réponse ventilatoire à l’hypoxie prend 7 à 10 jours pour se stabiliser (Lahiri, 1972; Dempsey et Forster, 1982). Cette amélioration de la ventilation est l’une des principales caractéristiques du processus d’acclimatement, de sorte qu’il est raisonnable de recommander que la période de travail en altitude soit de 10 jours au moins.
Les autres caractéristiques de l’acclimatement aux altitudes élevées nécessitent probablement des périodes bien plus longues pour se manifester. On peut donner comme exemple la polyglobulie, qui se stabilise après plusieurs semaines. On doit préciser cependant que la valeur physiologique de la polyglobulie est bien moins certaine qu’on ne le pensait auparavant. Winslow et Monge (1987) ont montré en fait que les niveaux extrêmement élevés de polyglobulie observés parfois chez les résidents permanents à des altitudes de l’ordre de 4 500 m sont contre-productifs, dans la mesure où il est parfois possible d’augmenter la capacité de travail si l’on diminue l’hématocrite en prélevant du sang pendant plusieurs semaines.
Une autre question importante est celle de la rapidité de la désadaptation. Dans l’idéal, les travailleurs ne devraient pas perdre toute l’adaptation acquise en altitude lorsqu’ils rejoignent leur famille au niveau de la mer. Les recherches sur la rapidité de la désadaptation sont malheureusement peu nombreuses, quoique certaines mesures semblent montrer que les changements de la réponse ventilatoire pendant la désadaptation sont plus lents que pendant l’adaptation (Lahiri, 1972).
Le temps nécessaire pour transporter les travailleurs du niveau de la mer jusqu’en altitude et inversement est également une question pratique à prendre en compte. La mine de Collahuasi, au nord du Chili, n’est qu’à quelques heures de route de la ville côtière d’Iquique où résident normalement la plupart des familles, mais si le travailleur habite Santiago, le voyage peut prendre plus d’une journée. Dans ces conditions, une période de travail en altitude de 3 à 4 jours seulement serait évidemment inefficace en raison du temps perdu dans les déplacements.
Les facteurs sociaux jouent également un rôle critique dans tous les programmes d’activité impliquant un éloignement de la famille. Même s’il existe des raisons médicales et physiologiques de penser que la période d’adaptation optimale doit être de 14 jours, le fait que les travailleurs ne soient pas disposés à quitter leur famille pour plus de 7 à 10 jours peut être un facteur déterminant. L’expérience acquise montre qu’un programme de 7 jours en altitude suivi de 7 jours au niveau de la mer, ou un programme de 10 jours en altitude suivi d’une même période au niveau de la mer représentent probablement les solutions les plus acceptables.
On notera qu’avec ce type de programme la personne ne parvient jamais ni à une adaptation complète en altitude, ni à une désadaptation complète au niveau de la mer; elle passe son temps à osciller entre les deux extrêmes, sans jamais retirer tout le bénéfice de chaque état. En outre, certains travailleurs se plaignent d’une extrême fatigue à leur retour au niveau de la mer et passent les 2 à 3 premiers jours à se rétablir. Il est possible qu’il existe un lien avec la mauvaise qualité du sommeil, fréquente aux altitudes élevées. Ces problèmes mettent en lumière notre ignorance des facteurs qui déterminent les meilleurs programmes et soulignent la nécessité d’une poursuite des recherches.
Quel que soit le programme adopté, il est extrêmement bénéfique que les travailleurs aient la possibilité de dormir à une altitude plus basse que celle du lieu de travail. Cette possibilité dépend naturellement de la topographie de la région: on ne peut pas donner aux travailleurs la possibilité de dormir à plus basse altitude s’il faut plusieurs heures pour s’y rendre, car cela entamerait la journée de travail d’une manière excessive. En revanche, s’il existe à quelques centaines de mètres plus bas un emplacement qui puisse être atteint en une heure, par exemple, l’installation de dortoirs à cette altitude plus basse sera de nature à améliorer la qualité du sommeil, le confort, le bien-être et la productivité des travailleurs.
Les effets nocifs des altitudes élevées sont causés par la faible pression partielle d’oxygène dans l’air. Cela est dû au fait que, si la concentration en oxygène est la même qu’au niveau de la mer, la pression barométrique est en revanche réduite. En altitude, on ne dispose malheureusement que de possibilités d’action limitées contre cette «agression climatique», comme l’a appelée Carlos Monge, le père de la médecine d’altitude au Pérou (Monge, 1948).
Une possibilité consiste à accroître la pression barométrique dans une zone restreinte; c’est le principe du sac de Gamow, qui est parfois utilisé pour le traitement d’urgence du mal des montagnes. Une pressurisation de zones étendues, telles que des locaux, est cependant difficile du point de vue technique; le fait de pénétrer dans une pièce où la pression a été augmentée, ou d’en sortir, pose également des problèmes médicaux, par exemple une gêne dans l’oreille moyenne en cas d’obstruction de la trompe d’Eustache.
On peut également accroître la concentration en oxygène de certaines parties du lieu de travail; c’est une solution relativement nouvelle qui est appelée à un grand avenir (West, 1995). Comme il a été dit plus haut, même après une période d’adaptation de 7 à 10 jours à une altitude de 4 500 m, il existe une très forte hypoxie qui continue de réduire la capacité de travail, les facultés mentales et la qualité du sommeil. Il serait donc très utile de réduire, si possible, le degré d’hypoxie sur certains chantiers.
On peut le faire en ajoutant de l’oxygène à la ventilation normale. Il est remarquable de constater à quel point un enrichissement relativement modeste en oxygène peut donner de bons résultats. On a montré que pour chaque augmentation de 1% de la concentration en oxygène (par exemple de 21 à 22%) l’altitude équivalente était réduite de 300 m (l’altitude équivalente est celle qui présente la même valeur de Po2 dans l’air inspiré que dans le local enrichi en oxygène). Ainsi, à une altitude de 4 500 m, une augmentation de 21 à 26% de la concentration en oxygène réduirait l’altitude équivalente de 1 500 m. On aurait donc une altitude équivalente de 3 000 m, qui est, elle, facilement tolérée. L’oxygène serait ajouté au système normal de ventilation du local et ferait donc partie de la climatisation. Il est admis que les locaux où l’on travaille doivent offrir des conditions de température et d’humidité confortables; dès lors, le contrôle de la concentration en oxygène peut être considéré comme une extension logique du contrôle exercé par l’humain sur son environnement.
L’enrichissement en oxygène a été rendu possible par la mise sur le marché d’équipements relativement peu onéreux capables de fournir d’importantes quantités d’oxygène pratiquement pur. L’équipement le plus prometteur est un concentrateur d’oxygène utilisant un tamis moléculaire. Cet appareil absorbe préférentiellement l’azote et produit ainsi à partir de l’air un gaz enrichi en oxygène. Il est difficile de produire de l’oxygène pur avec ce type de concentrateur, mais on peut obtenir facilement des concentrations d’oxygène de 90% dans l’azote qui présentent la même utilité pour l’application envisagée. Ces dispositifs peuvent fonctionner de manière continue. En pratique, on utilise en alternance deux tamis moléculaires, l’un étant purgé tandis que l’autre absorbe activement l’azote. Ces appareils nécessitent uniquement une alimentation en énergie électrique, normalement abondante dans les mines modernes. Pour donner une indication approximative du coût de l’enrichissement en oxygène, signalons qu’il est très facile de se procurer un petit modèle commercial produisant 300 litres d’oxygène à 90% par heure. Cet appareil a été mis au point pour produire de l’oxygène en vue du traitement à domicile des personnes atteintes d’une maladie pulmonaire. Sa puissance est de 350 W et son coût initial de l’ordre de 2 000 dollars E.-U. Cette machine suffit à élever de 3% la concentration en oxygène dans une pièce occupée par une personne, avec un niveau de ventilation minimal, quoique acceptable. On trouve également de très grands concentrateurs d’oxygène dans l’industrie de la pâte à papier. L’oxygène liquide pourrait également se révéler intéressant dans certaines situations.
Dans une exploitation minière, par exemple, il existe plusieurs zones où un enrichissement en oxygène peut être envisagé. L’une serait le bureau ou la salle de conférence du directeur, où des décisions importantes sont prises. En cas de situation de crise, par exemple s’il survenait un accident grave, ces lieux seraient plus propices à la réflexion que l’environnement hypoxique des autres zones; on sait en effet qu’une altitude de 4 500 m altère le fonctionnement du cerveau (Ward, Milledge et West, 1995). Un enrichissement en oxygène serait également bénéfique dans les laboratoires où l’on effectue des mesures de contrôle de la qualité. On peut aussi recourir à un enrichissement en oxygène dans les dortoirs pour améliorer la qualité du sommeil. Il serait facile de concevoir des essais en double aveugle de l’efficacité d’un enrichissement en oxygène à des altitudes de l’ordre de 4 500 m; ceux-ci devraient être effectués dès que possible.
Les complications pouvant résulter d’un enrichissement en oxygène doivent également être envisagées. On a évoqué le problème d’une aggravation des risques d’incendie, mais un accroissement de 5% de la concentration en oxygène à une altitude de 4 500 m crée en fait une atmosphère présentant une inflammabilité inférieure à celle de l’air au niveau de la mer (West, 1997). Il convient de noter que, si un enrichissement en oxygène accroît la valeur de la Po2, celle-ci reste très inférieure à celle du niveau de la mer. L’inflammabilité d’une atmosphère dépend en effet de deux facteurs (Roth, 1964):
Cet effet extincteur est légèrement réduit aux altitudes élevées, mais le résultat global est néanmoins une plus faible inflammabilité. L’oxygène pur ou pratiquement pur est évidemment dangereux, et l’on devrait prendre les précautions habituelles pour transférer l’oxygène du concentrateur aux conduites du système de ventilation.
La perte de l’acclimatement à l’altitude est parfois citée comme un inconvénient de l’enrichissement en oxygène. Mais il n’existe pas fondamentalement de différence entre le fait de pénétrer dans une pièce dont l’atmosphère est plus riche en oxygène et celui de redescendre à plus basse altitude. Chacun dormirait à plus basse altitude s’il pouvait le faire, et ce n’est donc pas un argument contre le recours à l’enrichissement en oxygène. Il est vrai que, toutes choses étant égales par ailleurs, une exposition fréquente à une altitude plus basse aurait pour effet de diminuer l’adaptation à une altitude supérieure, mais comme le but final est d’assurer l’efficacité du travail à l’altitude plus élevée de la mine, cet objectif pourrait être atteint plus facilement grâce à un enrichissement en oxygène.
On a parfois avancé qu’en modifiant ainsi l’atmosphère on risquait d’accroître, sur le plan juridique, la part de responsabilité revenant à l’installation en cas d’apparition d’une forme de maladie ayant un rapport avec l’hypoxie. En fait, c’est l’opinion opposée qui paraît plus raisonnable. Une personne victime par exemple d’un infarctus du myocarde alors qu’elle travaille dans une mine en altitude pourrait prétendre que c’est l’altitude qui a contribué à son état, mais l’on sait que toute méthode ayant pour résultat de réduire le stress hypoxique rend moins probable la survenue des maladies liées à l’altitude.
Les différents types de maladies dues à l’altitude, comme le mal aigu des montagnes, l’œdème pulmonaire d’altitude ou l’œdème cérébral d’altitude, ont déjà été traités dans ce chapitre, de sorte qu’il ne reste pas grand chose à ajouter, si ce n’est que toutes les personnes souffrant d’une maladie liée à l’altitude devraient être mises au repos. Cette mesure peut s’avérer suffisante dans le cas d’affections comme le mal aigu des montagnes. Si l’on dispose d’un équipement adéquat, on fera respirer de l’oxygène au patient. Néanmoins, si l’état de celui-ci ne s’améliore pas ou s’il se dégrade, le retour à plus basse altitude sera de loin la solution la meilleure. En effet, dans toutes les maladies liées à l’altitude, le sujet réagit en général rapidement à un retour à une altitude plus modérée. Dans les grandes entreprises qui disposent en permanence de moyens de transport, cela ne présente pas de difficulté.
Les entreprises pourraient prévoir un local pour recevoir une petite enceinte pressurisée dans laquelle on placerait le patient et où de l’air serait admis de manière à réduire l’altitude équivalente. Dans la pratique, on utilise couramment à cette fin un sac en matériau résistant, et notamment un modèle appelé sac de Gamow, d’après le nom de son inventeur. Mais comme le principal avantage d’un tel sac est d’être transportable et que ce critère n’est pas véritablement essentiel lorsqu’il s’agit d’une entreprise d’une certaine importance, il serait sans doute préférable d’utiliser une enceinte plus grande et rigide. Celle-ci devrait avoir des dimensions suffisantes pour qu’un membre de l’équipe soignante puisse y prendre place avec le patient. Il est évidemment essentiel que cette enceinte soit bien ventilée. Il est intéressant de noter que cette méthode d’accroissement de la pression atmosphérique semble dans certains cas plus efficace pour le traitement des maladies liées à l’altitude que l’administration au patient d’une concentration élevée d’oxygène, mais on ignore pourquoi il en est ainsi.
En général, cette affection s’atténue spontanément et le patient se sent beaucoup mieux après 1 ou 2 jours. On peut réduire son incidence par la prise d’acétazolamide (Diamox) et ce, à raison de 1 à 2 comprimés de 250 mg par jour avant l’arrivée en altitude, ou seulement à l’apparition des symptômes. Même les personnes présentant des symptômes atténués ont constaté que la prise d’un demi-comprimé le soir améliorait fréquemment la qualité du sommeil. Contre les maux de tête, on utilisera l’aspirine ou le paracétamol. Les formes graves de mal aigu des montagnes peuvent être traitées à la dexaméthasone, initialement à 8 mg, puis à 4 mg toutes les 6 heures. Mais la descente à une altitude plus basse constitue de loin le meilleur traitement en cas d’atteinte sérieuse.
Il s’agit d’une complication potentiellement grave du mal des montagnes, qui doit absolument être traitée. Dans ce cas également, la descente représente le meilleur traitement. En attendant l’évacuation, ou si celle-ci n’est pas possible, on devrait faire respirer de l’oxygène au patient ou le placer dans une enceinte pressurisée. On administrera de la nifédipine (un inhibiteur calcique), à raison d’une dose sublinguale de 10 mg suivie d’une dose de 20 mg à libération lente. Il en résulte une baisse de la pression artérielle pulmonaire; le traitement est souvent très efficace, mais le patient doit néanmoins être ramené à une altitude inférieure.
Il s’agit d’une complication qui peut être très grave et qui exige une descente immédiate. En attendant l’évacuation, ou si celle-ci est impossible, on fera respirer de l’oxygène au patient ou on le placera dans un environnement hyperbare. On le traitera à la dexaméthasone, initialement à 8 mg, puis à 4 mg toutes les 6 heures.
Comme nous l’avons mentionné plus haut, les personnes qui souffrent d’une forme grave de mal aigu des montagnes, d’œdème pulmonaire d’altitude ou d’œdème cérébral d’altitude encourent des risques de rechute si elles retournent à des altitudes élevées. En conséquence, lorsqu’un travailleur présente l’une de ces affections, on s’efforcera de lui trouver un emploi à plus basse altitude.
Le travail en altitude provoque diverses réponses biologiques qui ont été étudiées dans le présent chapitre. La réponse hyperventilatoire à l’altitude est de nature à accroître sensiblement la dose totale de substances dangereuses pouvant être inhalées par des personnes professionnellement exposées, comparativement aux personnes travaillant dans des conditions similaires au niveau de la mer. Cela signifie qu’il convient de réduire les limites d’exposition sur 8 heures employées comme base des normes d’exposition. Au Chili, par exemple, l’observation que la silicose progresse plus rapidement chez les mineurs travaillant en altitude a conduit à réduire le niveau d’exposition autorisé, exprimé en mg/m3, en proportion de la pression barométrique sur le lieu de travail. Aux altitudes moyennes, il peut en résulter une correction exagérée mais favorable au travailleur exposé. En revanche, il n’est pas nécessaire de corriger les valeurs limites d’exposition (VLE), exprimées en parties par million (ppm), car la proportion de millimoles de contaminant par mole d’oxygène dans l’air et le nombre de moles d’oxygène nécessaires à un travailleur restent à peu près constants à différentes altitudes, bien que le volume d’air conte-nant une mole d’oxygène varie.
Pour ne pas fausser les résultats, il est cependant nécessaire d’utiliser, pour déterminer la concentration en ppm, une méthode de mesure volumétrique vraie, comme celle de l’appareil d’Orsat ou des indicateurs de Bacharach Fyrite. Les tubes colorimétriques étalonnés pour des lectures en ppm ne donnent pas de mesure véritablement volumétrique, car leurs indications sont fournies en fait par une réaction chimique entre le contaminant atmosphérique et un réactif. On sait que, dans toutes les réactions chimiques, les substances se combinent proportionnellement au nombre de moles en présence et non proportionnellement aux volumes. La pompe à air actionnée à la main aspire un volume d’air constant dans le tube, quelle que soit l’altitude. Aux altitudes plus élevées, ce volume contiendra une masse plus faible de contaminant, ce qui donnera une lecture inférieure à la concentration volumétrique effective en ppm (Leichnitz, 1977). Les lectures devront donc être corrigées en multipliant la valeur relevée par la pression barométrique au niveau de la mer et en divisant le résultat par la pression barométrique à l’emplacement du prélèvement, et cela en employant les mêmes unités (Torr ou mbar, par exemple) pour les deux pressions.
Echantillonneurs à diffusion. Les lois de la diffusion des gaz indiquent que l’efficacité de rétention des échantillonneurs à diffusion est indépendante des variations de la pression barométrique. Les travaux expérimentaux de Lindenboom et Palmes (1983) montrent que d’autres facteurs, qui restent à déterminer, influencent le prélèvement de NO2 aux pressions réduites. L’erreur est d’environ 3,3% à une altitude équivalente de 3 300 m, et de 8,5% à 5 400 m. Les causes de cette variation et les effets de l’altitude sur d’autres gaz et vapeurs appellent des études plus poussées.
On ne dispose pas d’informations en ce qui concerne les effets de l’altitude sur les détecteurs de gaz portatifs étalonnés en ppm, qui sont équipés de capteurs électrochimiques à diffusion, mais on peut raisonnablement supposer qu’ils nécessitent la même correction que les tubes colorimétriques. La meilleure méthode serait manifestement de les étalonner en altitude avec un gaz d’essai de concentration connue.
Les principes de fonctionnement et de mesure des instruments électroniques devraient être examinés attentivement afin de déterminer si ces instruments doivent subir un nouvel étalonnage lorsqu’ils sont utilisés en altitude.
Pompes d’échantillonnage. Ces pompes sont généralement volumétriques — c’est-à-dire qu’elles déplacent un volume déterminé à chaque tour — mais comme elles constituent habituellement le dernier élément de la chaîne de prélèvement, le volume d’air effectivement aspiré est affecté par les pertes de charge causées par les filtres, la tuyauterie, le débitmètre et les autres éléments qui font partie de la chaîne. Les rotamètres indiqueront un débit inférieur au débit effectif.
La meilleure solution au problème de l’échantillonnage en altitude consiste à étalonner le système d’échantillonnage sur le lieu même du prélèvement, ce qui évite d’avoir à effectuer des corrections. Un laboratoire d’étalonnage à film à bulles, de la taille d’un porte-documents, est disponible auprès des fabricants de pompes d’échantillonnage. Cet équipement peut facilement être transporté sur place; il permet un étalonnage rapide en conditions réelles et comporte même une imprimante qui permet un enregistrement continu des résultats.
Les valeurs limites d’exposition (VLE) ont été établies pour une journée de travail normale de 8 heures et une semaine de travail normale de 40 heures. La tendance actuelle, en ce qui concerne le travail en altitude, consiste à travailler un plus grand nombre d’heures pendant un nombre de jours déterminé, puis à prévoir un retour vers la ville la plus proche pour une période de repos prolongée, de manière à maintenir la durée moyenne de travail dans la limite légale, qui est au Chili de 48 heures par semaine.
En cas d’écart par rapport à l’horaire de travail quotidien normal de 8 heures, il conviendra d’étudier s’il existe une accumulation de substances toxiques dans l’organisme en raison de l’accroissement de la durée d’exposition et de la réduction des temps de détoxification.
La réglementation chilienne en matière de santé au travail a adopté le «modèle de Brief et Scala» décrit par Paustenbach (1985) pour réduire les VLE dans le cas d’un horaire de travail prolongé. En altitude, on devrait également effectuer une correction pour tenir compte de la pression barométrique; il en résulte habituellement des réductions très substantielles des limites d’exposition admissibles.
Dans le cas de risques cumulatifs non soumis aux mécanismes de la détoxification, comme pour la silice, la correction pour tenir compte de l’allongement des horaires devrait être directement proportionnelle au nombre d’heures effectivement travaillées au-delà du nombre habituel de 2 000 heures par an.
Bruit. Le niveau de pression acoustique produit par un bruit d’une intensité donnée est directement lié à la densité de l’air; il en va de même pour la quantité d’énergie transmise. Il s’ensuit qu’en altitude la lecture fournie par un sonomètre et l’effet du bruit sur l’oreille interne sont réduits de la même manière, de sorte qu’il n’est pas nécessaire de procéder à une correction.
Accidents. L’hypoxie a une action prononcée sur le système nerveux central en réduisant les temps de réponse et en troublant la vision. On doit donc s’attendre à une augmentation du nombre des accidents. Au-dessus de 3 000 m, un apport d’oxygène aura un effet bénéfique sur les performances des personnes occupées à des tâches délicates.
|
Le contrôle et la préservation de la sécurité des travailleurs exigent de prendre particulièrement en compte les environnements en altitude. On peut s’attendre que les conditions régnant à grande altitude influencent la précision des instruments de prélèvement et de mesure étalonnés pour une utilisation au niveau de la mer. Les échantillonneurs actifs, par exemple, utilisent une pompe pour aspirer un certain volume d’air et le faire déposer sur un collecteur. Il est indispensable que le débit de la pompe soit mesuré avec précision pour pouvoir déterminer avec exactitude le volume d’air aspiré et, par conséquent, la concentration du contaminant. Les étalonnages du débit sont souvent effectués au niveau de la mer, mais ils peuvent être affectés par les variations de la densité de l’air à mesure que l’altitude augmente; les mesures effectuées ensuite en altitude ne seront donc pas valables. La précision des instruments de prélèvement et de mesure peut également être affectée en altitude par les variations de la température et de l’humidité relative. Dans l’évaluation de l’exposition des travailleurs à des substances inhalées, on doit tenir compte d’un facteur supplémentaire, à savoir l’accroissement de la ventilation pulmonaire avec l’acclimatement. Comme la ventilation augmente nettement après une montée en altitude, les travailleurs peuvent être exposés à des doses totales excessives de contaminants inhalés, même si les concentrations mesurées sont inférieures aux valeurs limites d’exposition. Kenneth I. Berger et William N. Rom |