

L’épidémiologie est connue pour être à la fois la science fondamentale de la médecine préventive et la source d’information de toute politique de santé publique. Différentes définitions opérationnelles de l’épidémiologie ont été proposées. Selon la plus simple, c’est l’étude de la manifestation des maladies ou d’autres caractéristiques reliées à la santé dans les populations humaines et animales. Les épidémiologistes s’intéressent non seulement à la fréquence des maladies, mais aussi aux différences de fréquence notées au sein des groupes; autrement dit, ils étudient la relation de cause à effet entre l’exposition et la pathologie. Les maladies ne surviennent jamais par hasard; elles ont des causes — assez souvent liées à l’activité humaine — qui sont évitables. En effet, on pourrait prévenir de nombreuses maladies si l’on en connaissait les causes. Les méthodes de l’épidémiologie ont joué un rôle déterminant dans l’identification de nombreux facteurs causals, ce qui, en retour, a permis d’élaborer des politiques de santé pour prévenir la maladie, les lésions et la mort prématurée.
Quel est le rôle de l’épidémiologie et quelles sont ses forces et ses faiblesses lorsque ses définitions et concepts sont appliqués à la santé au travail? Dans le présent chapitre, nous examinons ces questions, ainsi que l’adaptation des techniques épidémiologiques aux risques liés au travail. Ce premier article présente les différentes idées évoquées dans les articles suivants du chapitre.
L’épidémiologie du travail, également appelée épidémiologie professionnelle, a été définie comme étant l’étude de l’influence de l’exposition en milieu de travail sur la fréquence et la distribution des maladies et accidents dans la population. Il s’agit donc d’une discipline orientée vers l’exposition, reliant l’épidémiologie et la santé au travail (Checkoway et coll., 1989). A ce titre, les méthodes employées sont comparables à celles de l’épidémiologie en général.
L’objectif principal de l’épidémiologie du travail est la prévention par l’identification des conséquences de l’exposition professionnelle sur la santé. Cette branche de l’épidémiologie est donc axée sur la prévention, comme toute recherche en sécurité et santé au travail. La connaissance épidémiologique peut et doit être aisément mise en application. Toutefois, si la protection de la santé publique doit être la préoccupation première de la recherche épidémiologique, il n’y a pas de doute que d’autres intérêts cherchent souvent à l’influencer. Il convient donc d’être vigilant afin de minimiser cette influence lors de l’élaboration, de la conduite et de l’interprétation des études (Soskolne, 1985; 1989).
Un objectif secondaire de l’épidémiologie du travail est d’utiliser les résultats de sous-groupes particuliers pour réduire ou éliminer les risques dans l’ensemble de la population. Ainsi, à part les renseignements qu’ils donnent quant aux effets de l’exposition professionnelle sur la santé, les résultats des études épidémiologiques contribuent à l’estimation du risque associé à l’exposition du public aux mêmes facteurs, mais à un niveau moindre. Par exemple, la pollution découlant de l’utilisation de certains procédés industriels soumet les populations locales à une exposition de même nature, mais à un niveau beaucoup plus faible, que les travailleurs de l’industrie en cause.
Les domaines d’intervention de l’épidémiologie du travail sont les suivants:
La contribution de l’exposition professionnelle à la maladie, aux lésions et à la mort prématurée est connue depuis très longtemps et fait partie intégrante de l’histoire de l’épidémiologie. Il faut mentionner en particulier l’œuvre de Bernardino Ramazzini, le fondateur de la médecine du travail, qui fut l’un des premiers à faire revivre et à enrichir la tradition hippocratique du lien entre la santé et les facteurs environnementaux exogènes. En 1700, il écrivait dans De morbis artificum diatriba (Ramazzini, 1705; Saracci, 1995):
Il y a beaucoup de choses qu’un médecin doit savoir, soit du malade [...]; écoutons Hippocrate sur ce précepte: «Quand vous serez auprès du malade, il faut lui demander ce qu’il sent, quelle en est la cause, depuis combien de jours, s’il a le ventre relâché, quels sont les aliments dont il a fait usage. [...] qu’à ces questions il me soit permis d’ajouter la suivante: quel est le métier du malade?»
La revalorisation de l’observation clinique et de l’attention portée aux circonstances de l’apparition de la pathologie permirent à Ramazzini d’identifier et de décrire un bon nombre de maladies professionnelles qui furent ultérieurement étudiées par les médecins du travail et les épidémiologistes.
Utilisant cette approche, Pott fut le premier à signaler en 1775 (Pott, 1775) une relation possible entre le cancer et l’activité professionnelle (Clayson, 1962). Ses observations sur le cancer du scrotum chez les ramoneurs commençaient par une description de la maladie et se poursuivaient par les commentaires suivants:
Le sort de ces gens semble extrêmement dur: dans leur petite enfance, ils sont fréquemment traités avec une grande brutalité et souffrent du froid et de la faim; ils sont plongés dans des cheminées étroites, parfois très chaudes, où ils sont meurtris, brûlés et pratiquement asphyxiés et, quand ils atteignent l’âge de la puberté, ils sont souvent atteints d’une maladie particulièrement virulente, douloureuse et mortelle.
Sur ce dernier point, il n’y a pas le moindre doute, si ce n’est peut-être que l’on n’y a pas prêté suffisamment d’attention pour que le fait soit généralement connu. D’autres personnes sont atteintes d’un cancer des mêmes organes. D’autres également, à part les travailleurs du plomb, souffrent de la colique du Poitou et de la paralysie qui en découle; cela n’en reste pas moins une maladie à laquelle ils sont particulièrement sujets, tout comme le sont les ramoneurs au cancer du scrotum et des testicules.
La maladie, chez ces personnes, semble trouver son origine dans l’incrustation de suie au niveau du sillon scrotal, et ne paraît pas au premier abord être liée au mode de vie [...], mais les sujets sont ici jeunes, en bon état général, au moins au début; la maladie leur est venue de leur métier et, selon toute probabilité, au niveau local. Cette dernière circonstance peut, je crois, être raisonnablement présumée du fait que l’atteinte porte toujours sur les mêmes organes; tous ces éléments caractérisent (à première vue) un cas de cancer très différent de celui qui apparaît chez le vieillard.
Ce premier constat d’un cancer professionnel demeure aujourd’hui encore un modèle de lucidité, définissant clairement la nature de la maladie, la profession concernée et l’agent causal probable. L’auteur note une augmentation de l’incidence du cancer du scrotum chez les ramoneurs, sans toutefois présenter des données quantitatives pour étayer son affirmation.
Cinquante ans s’écoulèrent avant qu’Ayrton-Paris ne mentionne en 1822 (Ayrton-Paris, 1822) le développement fréquent de cancers du scrotum chez les fondeurs de cuivre et d’étain de Cornouailles et ne suspecte les vapeurs d’arsenic d’en être l’agent causal. Von Volkmann avait noté en 1874 des tumeurs cutanées chez les ouvriers de l’industrie de la paraffine en Saxe. Peu de temps après, en 1876, Bell faisait état de la possibilité que l’huile de schiste provoque des cancers de la peau (von Volkmann, 1874; Bell, 1876). Par la suite, le cancer est de plus en plus souvent attribué à des causes professionnelles (Clayson, 1962).
Parmi les toutes premières observations de maladies professionnelles, il faut retenir la surincidence du cancer du poumon chez les mineurs du Schneeberg (Harting et Hesse, 1879). Il est remarquable (et tragique) de constater qu’une récente étude cas-témoins démontre que l’épidémie de cancer du poumon au Schneeberg demeure un problème de santé publique majeur, plus d’un siècle après la première observation de 1879. L’histoire de la médecine du travail comprend de nombreux cas où des chercheurs ont observé une «augmentation» de la maladie et ont tenté de la quantifier. Ainsi, comme l’a signalé Axelson (1994), W.A. Guy a étudié en 1843 la phtisie des imprimeurs et a constaté, en se fondant sur un plan d’étude comparable à l’approche cas-témoins, que les compositeurs typographes couraient un plus grand risque que les opérateurs sur presse (Lilienfeld et Lilienfeld, 1979). Néanmoins, l’épidémiologie professionnelle moderne et ses méthodes n’ont commencé à se développer qu’au début des années cinquante, avec la publication d’importants travaux tels que les études sur le cancer de la vessie chez les teinturiers (Case et Hosker, 1954) et sur le cancer du poumon chez les gaziers (Doll, 1952).
Les articles de ce chapitre abordent tant la philosophie que les outils de l’enquête épidémiologique. Ils touchent plus particulièrement l’évaluation de l’exposition des travailleurs et les maladies qui surviennent parmi eux. Nous examinons, dans cet article, la possibilité de tirer des conclusions valides sur le lien de causalité éventuel entre l’exposition à des substances dangereuses et le développement de maladies.
La détermination de l’exposition individuelle au cours de la vie active constitue le cœur de l’épidémiologie professionnelle. La valeur informative d’une étude épidémiologique dépend en premier lieu de la qualité et de l’ampleur des données d’exposition disponibles. En deuxième lieu, les effets sur la santé (ou les pathologies) d’intérêt pour l’épidémiologiste du travail doivent pouvoir être précisément établis au sein d’un groupe accessible et bien défini de travailleurs. Enfin, l’épidémiologiste doit disposer de données sur les autres facteurs pouvant contribuer à la maladie en question pour que les effets de l’exposition professionnelle révélés par l’étude puissent être attribués à l’exposition elle-même et non à d’autres causes connues de la maladie considérée. Par exemple, dans un groupe de travailleurs exposés à un produit chimique soupçonné d’induire des cancers du poumon, certains peuvent être fumeurs. Dans ce cas, l’épidémiologiste doit déterminer quelle exposition ou quel facteur de risque (produit chimique, tabac ou combinaison des deux) est responsable d’une éventuelle augmentation du risque de cancer du poumon dans le groupe de travailleurs étudié.
Si une étude a comme seul élément d’information le fait qu’un travailleur a été employé dans une branche particulière, ses résultats ne peuvent relier les effets sur la santé qu’à cette seule branche. De même, si l’épidémiologiste dispose de renseignements sur l’exposition des travailleurs selon leur profession, il ne pourra tirer de conclusions directes qu’en rapport avec les professions considérées. Des déductions indirectes peuvent certes être faites sur l’exposition à des substances chimiques, mais leur fiabilité doit être évaluée au cas par cas. Toutefois, si l’épidémiologiste a accès à des informations sur le service ou le titre de l’emploi de chaque travailleur, il pourra tirer des conclusions à ce niveau de détail. Enfin, s’il connaît les substances que chaque personne manipule dans l’exercice de ses fonctions, il sera en mesure (en collaboration avec un hygiéniste industriel) d’atteindre le niveau le plus fin de connaissance de l’exposition, en l’absence de données de dosimétrie (rarement disponibles en pratique). De plus, ses conclusions donneront à la branche des informations très utiles pour améliorer la sécurité en milieu de travail.
Jusqu’à présent, l’épidémiologie a été une sorte de «boîte noire», car elle a étudié la relation entre exposition et maladie (les deux extrémités de la chaîne), sans considérer les étapes mécanistes intermédiaires. Cette démarche, en dépit de son manque apparent de subtilité, s’est avérée extrêmement utile: ainsi, toutes les causes connues du cancer humain ont été découvertes grâce aux outils épidémiologiques.
La méthode épidémiologique repose sur les renseignements disponibles: questionnaires, titres d’emplois ou autres indicateurs substitutifs de l’exposition, ce qui rend la conduite et l’interprétation des études épidémiologiques relativement simples.
Les limites d’une telle démarche plus ou moins simpliste de l’évaluation de l’exposition sont devenues évidentes ces dernières années, l’épidémiologiste se trouvant confronté à des problèmes de plus en plus complexes. Dans le domaine des cancers professionnels, la plupart des facteurs de risque connus ont été déterminés grâce aux hauts niveaux d’exposition rencontrés dans le passé, au nombre restreint de types d’exposition dans chaque métier, à l’importance des populations de travailleurs exposées et à une claire corrélation entre les indicateurs substitutifs et l’exposition aux substances chimiques (par exemple, travailleurs de la chaussure et benzène, construction navale et amiante, etc.). Aujourd’hui, la situation est sensiblement différente: les niveaux d’exposition ont été considérablement abaissés dans les pays occidentaux (ce point doit toujours être rappelé), les travailleurs sont exposés à de multiples produits et mélanges chimiques dans un même cadre professionnel (les agriculteurs, par exemple), les populations homogènes de sujets exposés sont de plus en plus difficiles à trouver et comptent en général peu de membres et la corrélation entre les indicateurs substitutifs et l’exposition est de moins en moins étroite. Les outils épidémiologiques ont par conséquent une sensibilité moindre par suite d’une classification imprécise de l’exposition.
De surcroît, l’épidémiologie s’est basée dans la plupart des études de cohortes sur des critères plutôt définitifs, comme la mort. Les travailleurs préféreraient sans doute autre chose qu’un brutal «décompte des cadavres» dans le cadre de l’étude des effets de l’exposition professionnelle sur la santé. C’est la raison pour laquelle l’emploi d’indicateurs plus directs de l’exposition et de la réponse précoce présente des avantages. Les marqueurs biologiques pourraient constituer un exemple de tels indicateurs.
L’emploi de marqueurs biologiques, comme le taux de plombémie ou les tests fonctionnels hépatiques, n’est pas récent en épidémiologie du travail. Toutefois, l’utilisation de techniques moléculaires dans les études épidémiologiques a rendu possible l’emploi des marqueurs biologiques pour évaluer l’exposition d’un organe cible, déterminer la prédisposition et diagnostiquer la maladie à un stade précoce.
Dans le contexte de l’épidémiologie du travail, les applications possibles des marqueurs biologiques sont les suivantes:
Ces utilisations ont soulevé un grand enthousiasme dans la communauté scientifique, mais, comme nous l’avons dit plus haut, il faudrait éviter tout excès d’optimisme à cause de la complexité méthodologique des nouveaux «outils moléculaires». Les marqueurs biologiques d’exposition chimique (tels que les adduits à l’ADN) présentent plusieurs limitations:
Sans compter les limites d’ordre méthodologique, il importe de prendre conscience du fait que les techniques moléculaires peuvent amener à écarter l’étude des risques environnementaux exogènes en faveur de l’identification des individus à haut risque, en personnalisant l’évolution du risque par détermination du phénotype, des mutations induites et des mutations acquises. Comme le mentionne McMichael (1994), nous nous orienterions alors vers une forme d’évaluation clinique, au détriment de l’épidémiologie centrée sur la santé publique. En nous intéressant de préférence aux individus, nous nous éloignerions de l’objectif primordial de la santé publique, qui est de créer un environnement moins dangereux (McMichael, 1994).
Deux questions importantes ressortent de l’utilisation des marqueurs biologiques:
Finalement, des preuves s’accumulent montrant que l’activation ou l’inactivation métabolique de substances à risque (en particulier des substances cancérogènes) varie considérablement d’un individu à l’autre et dépend en partie de la génétique. En outre, la variabilité interindividuelle de la sensibilité aux substances cancérogènes peut revêtir une importance particulière en cas de faible exposition professionnelle ou environnementale (Vineis et coll., 1994). Ces conclusions sont susceptibles d’influer profondément sur les décisions de réglementation tendant à concentrer l’évaluation du risque sur les personnes les plus vulnérables (Vineis et Martone, 1995).
L’article de Hernberg sur la conception des études épidémiologiques et leur application en médecine du travail met en évidence le concept de «base d’étude», définie comme étant la morbidité (en relation avec une certaine exposition) dans une population suivie pendant une période définie. La «base d’étude» représente non seulement une population (un groupe de personnes), mais aussi l’expérience de la survenue de la maladie dans cette population pendant une période donnée (Miettinen, 1985; Hernberg, 1992). Si ce concept uniciste de la «base d’étude» est retenu, il faudra reconnaître que les divers plans expérimentaux (études cas-témoins et études de cohortes) ne sont que des moyens différents de collecte d’information sur l’exposition et la maladie au sein d’une même base, et non pas des approches diamétralement opposées.
L’article de Sasco sur la validité des plans expérimentaux aborde les définitions et met en évidence l’importance de l’effet de confusion. Les chercheurs doivent toujours garder à l’esprit l’intervention possible des facteurs de confusion dans les études et on ne soulignera jamais assez que l’identification des variables confusionnelles fait partie intégrante de tout plan expérimental et de toute analyse. Deux aspects de la confusion doivent être abordés dans les études épidémiologiques:
Le temps et les variables temporelles, comme l’âge, la période de l’année, le temps écoulé depuis l’embauche ou la première exposition comptent, du point de vue méthodologique, parmi les facteurs les plus complexes à analyser en épidémiologie du travail. Cette question n’est pas abordée dans le présent chapitre, mais deux articles de méthodologie sur le sujet sont mentionnés dans les références bibliographiques (Pearce, 1992; Robins et coll., 1992).
L’article de Biggeri et Braga sur les statistiques et le titre même du présent chapitre indiquent que la méthodologie statistique ne saurait être dissociée de la recherche épidémiologique et ce, pour les raisons suivantes: a) une bonne compréhension de la statistique peut beaucoup contribuer à l’élaboration d’un plan d’étude adéquat; b) la statistique et l’épidémiologie partagent un héritage commun, toute la base quantitative de l’épidémiologie étant fondée sur la notion de probabilité (Clayton, 1992; Clayton et Hills, 1993). Dans plusieurs des articles qui suivent, la preuve empirique et la démonstration d’une relation de causalité sont évaluées par des arguments probabilistiques et des plans d’étude adaptés. Par exemple, l’accent est mis sur l’estimation de la mesure du risque, qu’il s’agisse d’un taux ou d’un risque relatif, et sur l’établissement de l’intervalle de confiance autour de ces estimations plutôt que sur l’exécution de tests de probabilité (Poole, 1987; Gardner et Altman, 1989; Greenland, 1990). Le chapitre contient une brève introduction au raisonnement statistique fondé sur la distribution binomiale. La statistique doit aller de pair avec le raisonnement scientifique, mais elle est sans valeur si la recherche n’est pas adéquatement préparée et exécutée. Statisticiens et épidémiologistes savent que le choix des méthodes conditionne la nature et l’étendue des observations réalisées. Un choix soigneux du plan expérimental est de ce fait déterminant pour assurer la validité des observations.
Le dernier article, signé par Vineis, aborde les démarches éthiques en recherche épidémiologique. Il importe de mentionner dans cette introduction que l’épidémiologie est une discipline qui, par définition, implique l’action préventive. Vis-à-vis de la protection des travailleurs et du public, l’éthique professionnelle nécessite de reconnaître ce qui suit:
Des personnes de formations diverses peuvent trouver leur place en épidémiologie du travail. La médecine, les soins infirmiers et la statistique sont quelques-unes des disciplines que l’on retrouve le plus souvent dans ce domaine. En Amérique du Nord, environ la moitié des épidémiologistes ont fait des études en sciences, tandis que l’autre moitié a suivi la voie du doctorat en médecine. Ailleurs, la plupart des épidémiologistes du travail sont des médecins. En Amérique du Nord, les épidémiologistes médecins sont en général considérés comme des «experts techniques» tandis que les diplômés en sciences sont les «experts en méthodologie». Il est souvent avantageux pour un «expert technique» de faire équipe avec un méthodologiste pour élaborer et exécuter la meilleure étude possible.
L’épidémiologie du travail nécessite de connaître autant les méthodes épidémiologiques, la statistique et l’informatique que la toxicologie, l’hygiène industrielle et les registres de maladies (Merletti et Comba, 1992). Comme les grandes études peuvent imposer d’établir un lien avec ces registres, il est utile de connaître les sources de données démographiques. La connaissance de l’organisation du travail et des entreprises est également importante. La rédaction de mémoires au niveau de la maîtrise et de thèses de doctorat permet aux étudiants d’acquérir les connaissances nécessaires pour diriger de grandes études fondées sur l’examen de documents ou sur des entrevues avec des travailleurs.
La contribution de l’exposition professionnelle à la maladie tant chez les travailleurs exposés que dans l’ensemble de la population est abordée, du moins en ce qui concerne le cancer, dans une autre partie de l’Encyclopédie. Nous tenons simplement à rappeler ici que, lorsqu’on fait une estimation, elle doit s’appliquer à une maladie particulière (et à un siège particulier dans le cas du cancer), à une période particulière ainsi qu’à une zone géographique, particulière elle aussi. En outre, elle doit s’appuyer sur des mesures précises de la proportion de personnes exposées et du degré d’exposition. Cela implique que la proportion de la maladie attribuable à la profession est susceptible de varier entre des valeurs très faibles ou nulles dans certaines populations et des valeurs très élevées dans d’autres vivant en milieu industriel où, par exemple, près de 40% des cancers du poumon sont attribuables à des expositions professionnelles (Vineis et Simonato, 1991). Les estimations non fondées sur un examen détaillé d’études épidémiologiques bien conçues ne peuvent, au mieux, être considérées que comme des suppositions éclairées d’une valeur limitée.
La plus grande partie de la recherche épidémiologique est réalisée dans les pays développés, où la réglementation et la prévention des dangers professionnels connus ont réduit le risque de maladie au cours des dernières décennies. Toutefois, nous avons assisté en même temps à un vaste transfert d’industries dangereuses vers le tiers monde (Jeyaratnam, 1994), où l’on produit maintenant les substances chimiques interdites aux Etats-Unis et en Europe. A titre d’exemple, les usines d’extraction de l’amiante ont quitté les Etats-Unis pour s’établir au Mexique et la production de la benzidine est passée de l’Europe occidentale à l’ex-Yougoslavie et à la Corée (Simonato, 1986; LaDou, 1991; Pearce et coll., 1994).
L’épidémie d’intoxications aiguës qui sévit dans quelques pays en développement reflète indirectement le niveau de risque professionnel et les conditions de travail qui prévalent dans le tiers monde. Selon certaines estimations, quelque 20 000 personnes meurent chaque année dans le monde par intoxication aux pesticides, mais ce chiffre est probablement très au-dessous de la réalité (Kogevinas et coll., 1994). On estime en même temps que 99% des décès par intoxication aiguë aux pesticides surviennent dans les pays en développement qui n’utilisent pourtant que 20% de la production mondiale de produits agrochimiques (Kogevinas et coll., 1994). Ainsi, même si la recherche épidémiologique semble indiquer une réduction des risques professionnels, cette baisse pourrait être simplement due au fait que la majorité des études sont réalisées dans les pays développés. Les risques professionnels pourraient tout simplement avoir été transférés au tiers monde et la charge mondiale de l’exposition professionnelle pourrait en fait avoir augmenté (Vineis et coll., 1995).
Pour des raisons évidentes, l’épidémiologie vétérinaire n’est pas directement liée à la médecine et à l’épidémiologie du travail. Néanmoins, les études épidémiologiques faites sur les animaux peuvent, pour plusieurs raisons, donner des indices sur les causes environnementales et professionnelles des maladies:
Les vétérinaires parlent d’une révolution épidémiologique en médecine vétérinaire (Schwabe, 1993) et des manuels traitant de cette nouvelle discipline ont été publiés (Thrusfield, 1986; Martin et coll., 1987). Assurément, les efforts conjoints des spécialistes de l’épidémiologie humaine et animale ont mis en lumière différents risques professionnels et environnementaux. Il y a lieu de mentionner à cet égard la contribution particulière de l’étude des effets des herbicides phénoxy sur le mouton et le chien (Newell et coll., 1984; Hayes et coll., 1990), des champs magnétiques (Reif et coll., 1995) et des pesticides (notamment les lotions antipuces) contaminés par des substances semblables à l’amiante sur le chien (Glickman et coll., 1983).
Il faut admettre que de nombreuses études épidémiologiques dans le secteur de la sécurité et de la santé au travail sont entreprises par suite de l’expérience et des préoccupations des travailleurs eux-mêmes (Olsen et coll., 1991). Souvent, les travailleurs — tant par le passé que de nos jours — ont l’impression que quelque chose ne va pas bien longtemps avant que la recherche ne leur donne raison. On peut donc considérer l’épidémiologie du travail comme un moyen d’interpréter le vécu des travailleurs, de recueillir et de regrouper les données de façon systématique pour permettre l’élaboration d’inférences sur les causes professionnelles de leurs problèmes de santé. En outre, les travailleurs eux-mêmes, les responsables de leur santé et leurs représentants sont les mieux à même d’interpréter les données recueillies. Pour cette raison, ils devraient toujours participer activement à toute enquête en milieu de travail. En effet, seule une participation directe pourra garantir le maintien de la sécurité au travail après le départ des enquêteurs. Le but de toute étude étant de produire des résultats pouvant servir à la prévention de la maladie et des accidents, sa réussite dépend en grande partie de la participation des sujets exposés à la collecte des données et à l’interprétation des résultats. Le rôle et l’utilisation des résultats de la recherche dans des procès en dommages-intérêts intentés par des travailleurs ayant subi un préjudice du fait d’une exposition professionnelle débordent le cadre de ce chapitre. Le lecteur intéressé trouvera des renseignements à ce sujet dans les références bibliographiques (Soskolne, Lilienfeld et Black, 1994).
L’approche participative en épidémiologie du travail est devenue courante dans certains pays, prenant fréquemment la forme de comités directeurs chargés de superviser les recherches, depuis l’élaboration du plan d’étude jusqu’à la publication du rapport. Ces comités multipartites regroupent souvent des représentants des syndicats, des milieux scientifiques, du patronat et des pouvoirs publics. En associant aux travaux des représentants de tous les groupes intervenants, ces comités favorisent une communication efficace des résultats, parce que chacun de leurs membres, ayant participé à la supervision de la recherche, se charge de faire part des conclusions à ses collègues. De cette manière, on a toutes les chances d’assurer la meilleure prévention possible.
Grâce à ces initiatives et à d’autres du même type, l’épidémiologie du travail profite de l’apport des travailleurs exposés et d’autres personnes que le problème à l’étude affecte d’une manière ou d’une autre. Cette façon de procéder devrait devenir de plus en plus courante dans la recherche épidémiologique (Laurell et coll., 1992). Il convient de rappeler que si l’objectif analytique du travail épidémiologique est l’estimation de l’importance et de la distribution du risque, celui de la recherche participative comprend aussi la prévention de ce risque (Loewenson et Biocca, 1995). Cette complémentarité de l’épidémiologie et de la prévention fait partie du message de l’Encyclopédie et de ce chapitre.
Les progrès récemment réalisés dans les domaines de la méthodologie épidémiologique, de l’analyse des données, ainsi que de l’évaluation et de la mesure de l’exposition (par exemple, nouvelles techniques de biologie moléculaire) sont aussi importants qu’avantageux, mais ils risquent de favoriser une approche réductionniste centrée sur l’individu au détriment des populations. Selon un auteur:
[...] l’épidémiologie a, dans une large mesure, cessé de faire partie d’une approche pluridisciplinaire destinée à découvrir l’origine de la maladie dans les populations, se transformant peu à peu en un ensemble de méthodes génériques visant seulement à mesurer l’association entre l’exposition et la maladie chez les individus [...] On a aujourd’hui tendance à négliger les aspects sociaux, économiques, culturels, historiques et politiques, ainsi que les autres facteurs démographiques en tant que causes premières des maladies [...] L’épidémiologie doit réintégrer le domaine de la santé publique et redécouvrir la perspective démographique (Pearce, 1996).
Les épidémiologistes du travail et du milieu ont un important rôle à jouer, non seulement en développant de nouvelles méthodes et applications épidémiologiques, mais aussi en s’assurant que ces méthodes s’inscrivent toujours dans une perspective démographique appropriée.
L’évaluation de l’exposition est une étape critique de toute enquête épidémiologique destinée à déterminer les risques en milieu de travail. La procédure d’évaluation de l’exposition se décompose en une série d’activités comprenant:
On reproche souvent aux études en médecine du travail de ne pas bien rendre compte de l’évaluation des expositions et, partant, d’aboutir à une classification différentielle ou non différentielle erronée de l’exposition, qui introduit des biais ou des imprécisions dans l’analyse exposition-effet. Des efforts ont été déployés pour améliorer la situation, comme en témoignent plusieurs conférences et textes internationaux récents consacrés à ce sujet (ACGIH, 1991; Armstrong et coll., 1992; Conference on Retrospective Assessment of Occupational Exposures in Epidemiology, 1995). A l’évidence, les progrès techniques créent de nouvelles perspectives dans ce domaine. Ces progrès comprennent le perfectionnement des outils analytiques, une meilleure compréhension des processus pharmacocinétiques et la découverte de nouveaux marqueurs biologiques de l’exposition. Les études en médecine du travail dépendant bien souvent des antécédents d’exposition, qui n’ont en général fait l’objet d’aucune collecte antérieure de données, elles nécessitent souvent une évaluation rétrospective de l’exposition, qui ajoute une dimension supplémentaire de complexité aux travaux. Toutefois, les critères d’évaluation et de contrôle sont constamment améliorés (Siemiatycki et coll., 1986). Bien sûr, les évaluations prospectives de l’exposition sont plus faciles à valider.
Le terme exposition désigne la concentration d’un agent à la frontière entre l’individu et son environnement. En général, on estime qu’il y a exposition lorsqu’on sait qu’un agent est présent sur les lieux de travail et que l’on peut raisonnablement s’attendre à ce que les travailleurs entrent en contact avec cet agent. Les expositions peuvent être exprimées sous forme d’une concentration moyenne pondérée sur une période de huit heures, qui correspond à la mesure de l’intensité de l’exposition moyennée pour un poste de huit heures. Les concentrations de pointe sont également des moyennes, mais elles sont calculées sur de plus courtes périodes, 15 minutes par exemple. L’exposition cumulée est la résultante du produit de l’intensité moyenne par la durée (par exemple, une moyenne pondérée sur huit heures multipliée par le nombre d’années travaillées à cette concentration moyenne). Selon la nature de l’étude et des paramètres d’intérêt, on peut vouloir calculer l’exposition de pointe, l’exposition moyenne, l’exposition cumulée ou encore l’exposition différée.
Par opposition à l’exposition, la notion de dose se rapporte au dépôt ou à l’absorption d’une substance par unité de temps. On peut ainsi estimer la dose ou la quantité quotidienne ingérée en partant des données des contrôles d’ambiance et en posant des hypothèses normales pour des facteurs tels que le rythme de la respiration et la pénétration cutanée. On peut également estimer la dose en se fondant sur les données de surveillance biologique. Idéalement, la dose devrait être mesurée dans l’organe cible.
Les principaux facteurs d’évaluation de l’exposition sont les suivants:
Ces facteurs comprennent le niveau d’effort physique qu’impose l’activité professionnelle et les antécédents médicaux de l’individu. Un soin particulier doit être apporté à l’évaluation de l’exposition à des agents persistants ou ayant tendance à s’accumuler dans l’organisme (par exemple, certains métaux, radionucléides ou composés organiques stables) parce que les charges corporelles peuvent augmenter insidieusement même si les concentrations dans l’environnement semblent basses.
Bien que la situation puisse paraître complexe, elle ne l’est bien souvent pas. Sans aucun doute, des études basées sur le bon sens ont largement contribué à la détermination de nombreux risques professionnels. Voici les principales sources d’information qui peuvent être utiles dans l’identification et la classification des expositions:
Un classement aussi détaillé que possible des expositions individuelles présente plusieurs avantages. Premièrement, il est évident que le caractère informatif d’une étude dépend de la qualité de la description de l’exposition considérée. Deuxièmement, cette qualité renforce la crédibilité des conclusions parce que les facteurs de confusion potentiels peuvent alors être abordés de manière satisfaisante. Par exemple, les individus exposés et les témoins diffèrent non seulement par leur statut d’exposition, mais aussi par d’autres facteurs mesurés ou non, en relation avec la pathologie considérée. Toutefois, si un gradient d’exposition peut être établi au sein d’une population, il est peu probable que le même niveau de confusion persiste parmi les sous-groupes d’exposition, ce qui renforce les résultats globaux de l’étude.
Une des approches les plus pratiques et les plus utilisées pour évaluer l’exposition a consisté à estimer indirectement les expositions en se fondant sur la catégorie professionnelle. L’emploi des matrices emplois-exposition est efficace lorsqu’on dispose d’antécédents professionnels complets et qu’il existe une relation raisonnablement constante entre les tâches et les expositions pour les postes étudiés. A l’échelle la plus large, des classifications normalisées par branche d’activité et par catégorie professionnelle ont été établies à partir de données couramment recensées ou des renseignements sur la profession tirés des certificats de décès. Malheureusement, les informations contenues dans ces grands fichiers se limitent souvent à la profession «actuelle» ou «ordinaire». En outre, comme ces classifications normalisées ne prennent pas en compte les conditions qui règnent dans des lieux de travail particuliers, on ne peut en général les considérer que comme de grossiers substituts de l’exposition.
Pour les études cas-témoins portant sur des collectivités ou fondées sur des registres, il a été possible d’obtenir une évaluation plus détaillée de l’exposition en faisant appel à des experts pour établir, à partir des antécédents professionnels recueillis au cours d’entretiens individuels, une évaluation semi-quantitative des expositions vraisemblables à certains agents (Siemiatycki et coll., 1986). Les experts, chimistes ou hygiénistes industriels, sont choisis pour aider à l’évaluation de l’exposition en raison de leurs connaissances et de leur familiarité avec des processus industriels divers. En associant les données des questionnaires détaillés et la connaissance des modes opératoires de l’industrie, on parvient à caractériser les différences d’exposition d’une installation à une autre.
La méthode des matrices emplois-exposition a également été employée avec succès dans des études consacrées à des branches d’activité ou des entreprises particulières (Gamble et Spirtas, 1976). Les antécédents professionnels de chaque individu (liste chronologique des différents postes et services auxquels un travailleur a été affecté) sont souvent conservés dans les dossiers du personnel de l’entreprise; quand ils sont disponibles, ils peuvent fournir l’historique complet des emplois occupés dans l’établissement en cause. Ces données peuvent être complétées par des entretiens individuels avec les participants à l’étude. L’étape suivante consiste à faire l’inventaire des titres d’emploi et des noms de services ou de zones de travail utilisés durant la période à l’étude. L’inventaire peut facilement compter plusieurs centaines, voire plusieurs milliers d’entrées dans le cas des grandes installations polyvalentes ou dans les entreprises d’une branche d’activité si l’on considère l’évolution avec le temps (souvent sur des dizaines d’années) des fonctions, des services et des procédés de fabrication dans les secteurs production, entretien, recherche, ingénierie, planification et administration. On peut faciliter le regroupement des données en plaçant tous les antécédents professionnels dans un fichier informatique puis en se servant de routines d’édition pour normaliser la terminologie des titres d’emploi. Les postes comportant des expositions semblables peuvent être regroupés pour simplifier la correspondance entre l’exposition et l’emploi. Toutefois, un tel regroupement doit, chaque fois que c’est possible, s’appuyer sur des données de mesure recueillies selon une stratégie d’échantillonnage solide.
Même avec l’informatisation des antécédents professionnels, il peut s’avérer difficile de faire le lien entre les données d’exposition et les individus. De toute évidence, les conditions de travail changent en fonction des mutations technologiques, de la demande des consommateurs et de l’évolution de la réglementation. La formulation des produits et le type de production saisonnière de nombreuses branches d’activité peuvent eux aussi changer. Certains de ces changements peuvent avoir été consignés dans les dossiers, mais cela est peu probable dans le cas des modifications saisonnières et d’autres changements marginaux touchant les procédés et la production. De même, les travailleurs peuvent avoir été formés pour accomplir différentes tâches et permuter entre les postes selon les exigences de la production. Toutes ces circonstances ajoutent à la complexité de l’établissement du profil d’exposition des travailleurs. Bien sûr, il existe aussi des milieux de travail qui sont restés pratiquement inchangés pendant des années. En dernière analyse, chaque activité doit faire l’objet d’une évaluation distincte.
En fin de compte, il sera nécessaire de résumer l’historique de l’exposition sur la vie entière de chacun des sujets d’une étude. L’influence considérable de ce facteur sur la mesure du risque en fonction de l’exposition ayant été démontrée (Suarez-Almazor et coll., 1992), il faut prendre grand soin de sélectionner la mesure synthétique de l’exposition la plus appropriée.
La surveillance des expositions professionnelles est une activité fondamentale pour la protection de la santé des travailleurs. Il arrive que des données d’hygiène industrielle existent déjà au moment de la planification d’une étude épidémiologique. Si tel est le cas, ces données doivent être revues pour déterminer à quel point la population cible a été couverte, combien d’années sont enregistrées dans les dossiers et dans quelle mesure les données pourront être reliées aux professions, aux zones de travail et aux individus. Ces éléments seront utiles pour évaluer la faisabilité de l’étude épidémiologique et pour déterminer les lacunes auxquelles on pourrait remédier en élargissant l’échantillonnage.
Il est particulièrement important de déterminer la meilleure façon de relier les données de mesure à des postes et à des individus spécifiques. Les prélèvements d’ambiance et les prélèvements individuels peuvent aider les hygiénistes industriels à découvrir les sources d’émissions afin de les éliminer, mais ils sont moins utiles pour caractériser les expositions réelles des travailleurs sauf si ceux-ci ont déjà fait l’objet d’études précises de temps et mouvements. Par exemple, la surveillance continue d’une zone peut révéler des variations d’exposition à certains moments de la journée, mais la question demeure de savoir si des travailleurs étaient présents alors.
Les données d’un échantillonnage individuel apportent des estimations plus affinées de l’exposition du travailleur si l’échantillonnage est réalisé dans des conditions représentatives, si les mesures de protection individuelle sont correctement prises en compte et si les tâches et les procédés sont relativement constants d’un jour à l’autre. Les prélèvements individuels peuvent facilement être reliés aux individus grâce à l’utilisation de marqueurs d’identification. Les données correspondantes peuvent alors être étendues à d’autres travailleurs occupant les mêmes postes et à d’autres périodes. Néanmoins, en se fondant sur leur propre expérience, Rappaport et ses collaborateurs (1993) ont souligné le fait que les travailleurs membres de groupes d’exposition considérés comme homogènes peuvent être soumis à des expositions très différentes. Là encore, l’avis d’un expert est nécessaire pour juger si l’on peut retenir ou non la notion de groupes d’exposition homogènes.
Certains chercheurs ont réussi à utiliser à la fois la matrice d’exposition professionnelle et des données des contrôles d’ambiance pour estimer les expositions dans les cellules de la matrice. Quand des mesures manquent, il est possible de remplir les cases vides à l’aide de données d’exposition modélisées. Généralement, il faut pour cela mettre au point un modèle reliant les concentrations dans l’environnement à des paramètres plus faciles d’accès (par exemple, volumes de production, caractéristiques physiques de l’établissement, comme le genre de système de ventilation utilisé, la volatilité des substances et la nature de l’activité). Le modèle est construit pour des installations où les concentrations d’ambiance sont connues et est ensuite appliqué en vue d’estimer les concentrations dans une installation similaire pour laquelle on dispose de données de mesure, mais pas d’informations sur les autres paramètres, comme les matières premières et les volumes de production. Cette approche est particulièrement utile dans le cas d’une estimation rétrospective des expositions.
Un autre aspect important de l’évaluation concerne l’exposition à des mélanges. Premièrement, d’un point de vue analytique, la détection spécifique de composés chimiquement proches et l’élimination des interférences liées aux autres substances présentes dans l’échantillon ne sont pas toujours à la portée d’une méthode analytique. Il faut souvent évaluer les diverses limites des méthodes analytiques utilisées pour obtenir les données et modifier en conséquence les objectifs de l’étude. Deuxièmement, il arrive que certaines substances soient presque toujours employées en association et apparaissent de ce fait approximativement dans les mêmes proportions relatives dans tout l’environnement de la zone à l’étude. Dans ce cas, les analyses statistiques internes ne permettront pas de distinguer si les effets sont dus à l’un ou l’autre des produits ou à la combinaison de plusieurs d’entre eux. On ne pourra alors se prononcer qu’en se basant sur des études externes où n’intervenait pas la même association de produits. Enfin, dans les situations où différentes substances sont alternativement employées en fonction des spécifications requises (par exemple, recours à différents colorants pour obtenir les teintes désirées), il peut arriver que l’on ne puisse pas attribuer les effets à une substance précise.
Les marqueurs biologiques sont des altérations moléculaires, biochimiques ou cellulaires qui peuvent être mesurées dans des milieux biologiques tels que les tissus, les cellules ou les liquides organiques humains. L’une des raisons fondamentales du développement des marqueurs biologiques d’exposition est de donner une estimation de la dose interne d’une substance particulière. Ces marqueurs sont surtout utiles en cas d’exposition probable par voies multiples (inhalation et absorption cutanée, par exemple), lorsque les équipements de protection sont portés de façon intermittente ou que les conditions d’exposition sont imprévisibles. La surveillance biologique est particulièrement précieuse quand on sait que les agents en cause ont une demi-vie relativement longue. Dans l’optique statistique, son avantage sur la surveillance de l’air ambiant est déjà perceptible dans le cas de substances dont la demi-vie peut n’être que de dix heures, selon le degré de variabilité de l’environnement (Droz et Wu, 1991). La très longue demi-vie de produits comme la dioxine (mesurée en années) en fait des objets parfaits de surveillance biologique. Comme pour les méthodes analytiques de mesure des concentrations dans l’air ambiant, il ne faut pas perdre de vue les risques d’interférences. Par exemple, avant d’utiliser un métabolite particulier comme marqueur biologique, il faut établir s’il peut être produit par métabolisation d’autres substances courantes, comme celles que l’on trouve dans certains médicaments ou dans la fumée de cigarette. D’habitude, une connaissance générale de la pharmacocinétique d’un agent s’impose avant de recourir à la surveillance biologique comme base d’évaluation de l’exposition.
Les milieux de mesure les plus fréquents sont l’air alvéolaire, l’urine et le sang. Les échantillons d’air alvéolaire permettent de caractériser l’exposition de courte durée à des solvants, survenue dans les minutes ou les heures ayant précédé le prélèvement. Les échantillons urinaires sont recueillis d’ordinaire pour déterminer la vitesse d’excrétion des métabolites de la substance à l’étude. Les échantillons sanguins peuvent être prélevés pour une mesure directe de la substance ou des métabolites ou encore pour le dosage des protéines ou des adduits à l’ADN (adduits à l’albumine ou à l’hémoglobine et adduits à l’ADN dans les lymphocytes circulants). Les cellules de tissus accessibles, comme celles de l’épithélium de la muqueuse buccale, peuvent également être prélevées pour identifier les adduits à l’ADN.
Le dosage de l’activité cholinestérasique érythrocytaire et plasmatique est un exemple de l’utilisation d’altérations biochimiques pour mesurer l’exposition. Comme les pesticides organophosphorés inhibent l’activité cholinestérasique, la mesure de cette activité avant et après une exposition probable à ces produits peut être un indicateur utile de l’intensité d’exposition. Cependant, à mesure que l’on progresse dans l’éventail des altérations biologiques, il devient plus difficile de faire la distinction entre les biomarqueurs de l’exposition et les biomarqueurs de l’effet. En général, les mesures d’effet ont tendance à être non spécifiques; il faut donc évaluer d’autres explications potentielles de l’effet avant d’envisager l’emploi de ce paramètre comme marqueur d’exposition. Les mesures d’exposition doivent être liées directement au produit à l’étude ou alors il faut de solides arguments pour relier une mesure indirecte à ce produit. En dépit de ces réserves, la surveillance biologique semble constituer un moyen prometteur d’améliorer l’évaluation de l’exposition à l’appui des études épidémiologiques.
Il est nécessaire, dans les études d’épidémiologie du travail, de comparer un groupe de travailleurs exposés à un groupe de sujets non exposés. Une telle distinction est grossière, mais peut mettre les problèmes en évidence. Malgré tout, plus la mesure de l’exposition sera précise, plus utile sera l’étude, particulièrement pour déterminer et élaborer des programmes d’intervention bien ciblés.
Les chercheurs ont de la chance quand ils disposent d’une chronologie détaillée de la carrière des travailleurs pouvant leur fournir un inventaire des postes occupés au fil des ans. Pour ces travailleurs, ils sont en mesure d’établir une matrice emplois-exposition permettant d’associer chaque changement de poste à des données d’exposition spécifiques.
Le profil détaillé d’exposition doit être synthétisé à des fins analytiques pour déterminer s’il est possible de déceler des schémas ou des tendances pouvant être reliés aux problèmes de sécurité et de santé au travail. A titre d’exemple, on peut imaginer une liste de vingt postes auxquels un travailleur a été affecté au cours de sa carrière. Il y a alors plusieurs moyens de résumer le détail de l’exposition (pour chacun des vingt postes de cet exemple) en tenant compte de la durée, de la concentration, de la dose ou du niveau d’exposition.
Il importe de noter, cependant, que différentes conclusions peuvent être tirées d’une même étude selon la méthode employée (Suarez-Almazor et coll., 1992). Le tableau 28.1 présente cinq indicateurs résumant l’exposition au cours de la vie professionnelle.
|
Indicateur d’exposition |
Formule |
Dimensions ou unités |
|
Indice d’exposition cumulée (IEC) |
Σ (niveau × temps d’exposition) |
Niveau et temps |
|
Niveau moyen (NM) |
Σ (niveau × temps d’exposition)/temps total d’exposition |
Niveau |
|
Niveau maximal atteint |
Niveau maximal atteint pendant plus de 7 jours |
Niveau |
|
Niveau moyen pondéré dans le temps (TWA) |
Σ (niveau × temps d’exposition)/temps total de travail |
Niveau |
|
Temps total d’exposition (TTE) |
Σ temps d’exposition |
Temps |
D’après Suarez-Almazor et coll., 1992.
Indice d’exposition cumulée. L’indice d’exposition cumulée (IEC) est l’équivalent de la dose dans les études toxicologiques. Il représente la somme, sur toute la vie professionnelle, des produits du niveau d’exposition par la durée d’exposition dans chacun des emplois successivement occupés. L’IEC comporte une dimension de temps.
Niveau moyen. Le niveau moyen d’exposition (NM) est égal à l’IEC (c’est-à-dire à la somme des produits des niveaux d’exposition par la durée d’exposition pour tous les postes successifs) divisé par le temps total d’exposition tous niveaux confondus (pourvu qu’ils soient supérieurs à zéro). Le NM est indépendant du temps. Cette mesure synthétique de l’exposition sera la même chez une personne exposée durant une longue période à une forte concentration que chez une personne exposée à la même concentration durant une courte période. Pour un jeu apparié dans une étude cas-témoins, le NM exprime le niveau moyen d’exposition par unité de temps d’exposition. Il s’agit d’un niveau moyen pour la durée effective d’exposition à l’agent considéré.
Niveau maximal atteint. Le niveau maximal atteint est déterminé en repérant dans les antécédents professionnels le plus fort niveau auquel la personne a été exposée pendant au moins sept jours. Cet indicateur peut mal représenter l’exposition d’une personne durant sa vie professionnelle puisque, du fait de sa conception, il repose sur une maximisation et non sur une moyenne. De ce fait, ses unités ne comportent pas la dimension temps.
Niveau moyen pondéré dans le temps. Le niveau moyen pondéré dans le temps ou TWA (de l’anglais, time-weighted average) est égal à l’indice d’exposition cumulée divisé par la période totale d’emploi. Pour des jeux appariés dans une étude cas-témoins, ce niveau est calculé sur le temps total de travail. C’est en cela que le niveau TWA diffère du niveau moyen, qui est calculé sur le temps total d’exposition. Ce niveau peut donc être considéré comme un indicateur d’exposition moyenne par unité de temps travaillé, indépendamment de l’exposition en soi.
Temps total d’exposition. Le temps total d’exposition (TTE) est la somme de toutes les durées d’exposition, en unités de temps. Le TTE est séduisant par sa simplicité. Cependant, il est admis que les effets sur la santé doivent non seulement être reliés à la durée de l’exposition, mais aussi à son intensité (concentration ou niveau).
De toute évidence, l’utilité d’un indicateur synthétique d’exposition est déterminée par le poids qu’il attribue à la durée ou à la concentration ou aux deux réunis. C’est pourquoi différentes mesures peuvent produire des résultats différents (Walker et Blettner, 1985). Dans une situation idéale, l’indicateur retenu devrait se baser sur un jeu d’hypothèses justifiables du point de vue du mécanisme biologique postulé de l’agent ou de la maladie à l’étude (Smith, 1987). Il n’est cependant pas toujours possible de faire un tel choix. Très souvent, on ne connaît pas l’effet biologique de la durée d’exposition ou de la concentration de l’agent étudié. C’est alors que l’utilisation de plusieurs indicateurs d’exposition peut aider à définir un mécanisme pouvant expliquer la façon dont l’exposition agit.
En l’absence d’un modèle validé d’évaluation de l’exposition, il est recommandé d’employer une gamme d’indicateurs pour estimer le risque. Cette approche facilite la comparaison des résultats obtenus dans des études différentes.
L’épidémiologie mesure la survenue des maladies et quantifie les associations entre maladie et exposition.
La maladie peut être mesurée par des fréquences (dénombrements), mais on préfère la décrire par des taux, qui sont composés de trois éléments: le nombre de personnes atteintes (numérateur), le nombre de personnes dans la population source ou la population de référence (c’est-à-dire la population exposée ou à risque) dont font partie les personnes atteintes et la période considérée. Le dénominateur du taux est le nombre total d’unités de temps-personnes de la population de référence. Les taux permettent de faire des comparaisons plus utiles entre des populations de tailles différentes que les valeurs seules. Le risque, probabilité qu’un individu développe une maladie dans une période donnée, est un rapport compris entre 0 et 1, qui n’est pas un taux en soi. Le taux d’attaque, proportion d’individus d’une population qui sont touchés dans une période donnée, est techniquement une mesure de risque et non un taux.
La morbidité spécifique comprend l’incidence, qui correspond au nombre de personnes nouvellement atteintes par la maladie considérée. La prévalence est le nombre de cas existants. La mortalité est le nombre d’individus qui meurent.
L’incidence est définie par le nombre de nouveaux cas diagnostiqués dans une période donnée, tandis que le taux d’incidence est égal à ce nombre divisé par le total de temps-personnes dans la population source (voir tableau 28.2). Dans le cas du cancer, «taux» s’entend habituellement du taux annuel pour 100 000 personnes. Pour les maladies plus courantes, les taux peuvent être exprimés par rapport à un nombre moindre d’individus. Par exemple, le taux d’anomalies à la naissance est en général exprimé par 1 000 naissances vivantes. L’incidence cumulée, proportion de personnes devenant des cas dans une période donnée, est une mesure du risque moyen d’une population.
|
Nouveaux cas diagnostiqués |
10 |
|
Cas vivants antérieurement diagnostiqués |
12 |
|
Décès, toutes causes confondues* |
5 |
|
Décès liés à la maladie |
3 |
|
Effectif de la population |
100 |
|
Années d’observation |
5 |
|
Incidence |
10 personnes |
|
Taux d’incidence annuel |
|
|
Prévalence ponctuelle (à la fin des 5 ans) |
(10 + 12 – 3) = 19 personnes |
|
Prévalence sur la période (5 ans) |
(10 + 12) = 22 personnes |
|
Taux annuel de décès |
|
|
Taux annuel de mortalité |
|
* Par souci de simplification, cet exemple suppose que tous les décès surviennent à la fin de la période de cinq ans, de sorte que les 100 membres de la population sont vivants durant toute la période.
La prévalence comprend la prévalence ponctuelle ou instantanée, nombre de cas de maladie à un moment précis, et la prévalence de période, nombre total de cas pathologiques observés à certains moments au cours d’une période donnée.
La mortalité, qui correspond aux décès plutôt qu’aux nouveaux cas de maladie diagnostiqués, reflète les facteurs étiologiques de la maladie, mais aussi des facteurs de qualité des soins médicaux, tels que le dépistage, l’accès aux soins et l’existence de traitements efficaces. Par conséquent, la formulation d’hypothèses et la recherche de causes peuvent être plus utiles et plus faciles à interpréter quand elles se fondent sur l’incidence plutôt que sur la mortalité. Cependant, dans les grandes populations, on dispose plus souvent de données sur la mortalité que sur l’incidence.
L’expression taux de décès est généralement reliée aux décès de toutes origines, tandis que le taux de mortalité reflète les décès dus à une cause spécifique. Pour une maladie donnée, le taux de létalité (techniquement un rapport et non un taux) est le nombre d’individus qui meurent de la maladie dans une période donnée, divisé par le nombre d’individus atteints. Le taux de survie est le complément du taux de létalité. On utilise communément le taux de survie à cinq ans dans le cas de maladies chroniques telles que le cancer.
La survenue d’une maladie peut varier parmi les sous-groupes de la population ou dans le temps. Une mesure s’appliquant à une population entière indépendamment de tout sous-groupe est appelée taux brut. Par exemple, le taux d’incidence pour tous les groupes d’âge combinés est un taux brut. Les taux des différents groupes d’âge sont les taux spécifiques selon l’âge. Pour comparer deux populations ou plus dont les distributions d’âge diffèrent, il faut calculer les taux ajustés selon l’âge en multipliant chaque taux spécifique selon l’âge par le pourcentage de la population standard (par exemple, la population des Etats-Unis en 1970) qui se situe dans ce groupe d’âge, puis en additionnant tous les groupes d’âge pour obtenir le taux général ajusté selon l’âge. On peut ajuster les taux sur d’autres facteurs que l’âge, par exemple la race, le sexe ou le tabagisme, si les taux spécifiques de chaque catégorie sont connus.
La surveillance et l’évaluation des données descriptives peuvent fournir des indications sur l’étiologie de la maladie, sur les sous-groupes à risque élevé susceptibles de bénéficier d’interventions ou de programmes de dépistage et sur l’efficacité de tels programmes. Les sources d’information utilisées pour la surveillance sont les certificats de décès, les dossiers médicaux, les registres du cancer, les registres d’autres pathologies (anomalies à la naissance, insuffisance rénale terminale), les registres d’exposition professionnelle, les dossiers de santé ou d’invalidité des compagnies d’assurances et les dossiers d’accidents du travail.
L’épidémiologie tente d’identifier et de quantifier les facteurs qui influent sur les maladies. Dans le cas le plus simple, l’apparition d’une maladie chez des individus exposés à un facteur suspect est comparée à la survenue chez des individus non exposés. L’importance de l’association entre exposition et maladie peut s’exprimer en termes absolus ou relatifs (voir encadré).
|
||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Les effets absolus sont mesurés par les différences de taux et les différences de risques (voir tableau 28.3). Une différence de taux est le résultat de la soustraction de deux taux. Par exemple, si le taux d’incidence de la leucémie parmi les travailleurs exposés au benzène est de 72 années-personnes pour 100 000 et le taux chez les travailleurs non exposés est de 12 pour 100 000, la différence de taux est de 60 années-personnes pour 100 000. Une différence de risques, qui est une différence entre des risques ou des incidences cumulées, peut aller de –1 à 1.
|
Cas |
Années-personnes à risque |
Taux pour 100 000 |
|
|
Exposés |
100 |
20 000 |
500 |
|
Non-exposés |
200 |
80 000 |
250 |
|
Total |
300 |
100 000 |
300 |
|
Différence des risques (DR) |
= 500/100 000 – 250/100 000 |
||
|
Rapport des taux (ou risque relatif RR) = |
|||
|
Risque attribuable chez les exposés (RAe) |
= 100/20 000 – 200/80 000 |
||
|
Risque attribuable pour 100 sujets exposés (RAe %) = |
|||
|
Risque attribuable dans la population (RAP) |
= 300/100 000 – 200/80 000 |
||
|
Risque attribuable dans la population pour 100 sujets exposés (RAP%) = |
|||
* Entre parenthèses figure l’intervalle de confiance à 95% calculé selon les formules de l’encadré.
Les effets relatifs sont basés sur les rapports de taux ou de mesures des risques, plutôt que sur les différences. Un rapport des taux est le ratio d’un taux dans une population au taux d’une autre population. Le rapport des taux est également appelé le ratio de risque, le risque relatif, le taux relatif ou le ratio des taux d’incidence (ou de mortalité). Il est sans dimension et va de 0 à l’infini. Quand le taux est identique dans deux groupes (ce qui signifie qu’il n’y a pas d’effet dû à l’exposition), le rapport des taux est égal à l’unité. Il est supérieur à 1 pour une exposition qui augmente le risque tandis qu’il est compris entre 0 et 1 en cas d’intervention d’un facteur de protection. L’excès de risque relatif est le risque relatif moins 1. Par exemple, pour un risque relatif de 1,4, il est de 40%.
Dans les études cas-témoins, on sélectionne des personnes atteintes par la maladie (les cas) et des personnes qui en sont exemptes (les témoins) et on compare les expositions antérieures des deux groupes. La probabilité d’appartenir à la catégorie des cas exposés est comparée à la probabilité d’appartenir à celle des témoins exposés. L’effectif complet des populations sources exposées et non exposées n’étant pas connu, les taux de maladie ne peuvent être calculés. En revanche, on peut comparer les cas exposés aux témoins exposés en déterminant la cote relative (odds) ou le rapport des cotes, mieux connus sous l’appellation anglaise odds ratio ou son sigle OR (voir tableau 28.4).
|
Cas |
Témoins |
|
|
Exposés |
18 |
55 |
|
Non-exposés |
5 |
140 |
|
Total |
23 |
195 |
|
Rapport des cotes (odds ratio ou OR) = |
||
|
Risque attribuable pour 100 sujets exposés (RAe%) = |
||
|
Risque attribuable dans la population (RAP%) = |
||
* Entre parenthèses figure l’intervalle de confiance à 95% calculé selon les formules de l’encadré
Source: adapté de Hayes et coll., 1986.
Les mesures relatives de l’effet sont plus fréquemment employées que les mesures absolues pour décrire la force d’une association. Les mesures absolues donnent toutefois une meilleure indication de l’impact d’une association sur la santé publique. Une petite augmentation relative d’une pathologie courante, comme les maladies cardio-vasculaires, peut affecter davantage de personnes (grande différence de risque) et avoir plus d’impact sur la santé publique qu’une grande augmentation relative (mais une petite différence absolue) d’une pathologie rare comme l’angiosarcome hépatique.
Souvent appliqué aux mesures d’un effet, le test de signification statistique permet d’évaluer la vraisemblance que l’effet observé se distingue de l’hypothèse nulle (absence d’effet). A la différence de ce qui se fait dans d’autres domaines de la recherche biomédicale, où l’on exprime la signification par des valeurs de p, les études épidémiologiques se fondent plutôt sur les intervalles de confiance (IC). Par exemple, l’IC à 95% est la fourchette des valeurs de mesure de l’effet qui comprend la mesure estimée à partir des données de l’étude et qui a 95% de chances de comprendre la vraie valeur. On considère peu probable que les valeurs extérieures à l’intervalle comprennent la vraie valeur de l’effet. Quand l’IC d’un rapport de taux comprend l’unité, il n’y a pas de différence statistiquement significative entre les deux groupes comparés.
Les intervalles de confiance sont plus utiles que les valeurs de p seules. La valeur de p dépend de deux facteurs: elle est élevée si la mesure d’association est grande (rapport des taux, différence des risques) ou si les populations étudiées sont grandes. Par exemple, une petite différence entre les taux de maladie observés dans une grande population peut donner une valeur de p hautement significative. Mais la raison d’une forte signification ne peut pas être identifiée par la seule valeur de p. Les intervalles de confiance, en revanche, permettent de dissocier les deux facteurs. Premièrement, les valeurs de mesure de l’effet et les nombres compris dans l’intervalle reflètent l’ampleur de l’effet. C’est ainsi que des risques relatifs plus élevés témoignent d’un effet plus fort. Deuxièmement, la taille de la population influe sur la largeur de l’intervalle de confiance. De petites populations ayant des estimations statistiquement instables donnent des intervalles de confiance plus étendus que de grandes populations.
Le niveau de confiance choisi pour exprimer la variabilité des résultats (la «signification statistique») est arbitraire, mais a traditionnellement été fixé à 95%, ce qui correspond à une valeur de p de 0,05. Un IC à 95% a 95% de chances de contenir la vraie valeur de mesure de l’effet. On se sert à l’occasion d’autres niveaux de signification, 90% par exemple.
Les expositions peuvent être dichotomiques (exposé ou non exposé) ou comporter différents niveaux. Les mesures d’effet (réponses) peuvent varier en fonction du niveau d’exposition. L’évaluation de la relation exposition-réponse est un important aspect de l’interprétation des données épidémiologiques. La relation exposition-réponse est analogue à la relation «dose-effet» dans les études sur les animaux. Si la réponse augmente avec le niveau d’exposition, la causalité de l’association est plus probable qu’en l’absence d’une tendance claire. Les tests statistiques permettant d’évaluer les relations exposition-effet comprennent le test élargi de Mantel et le test de tendance du chi-carré.
Pour prendre en compte des facteurs autres que la principale exposition étudiée et la maladie, les mesures d’association peuvent être standardisées par stratification ou par régression. La stratification consiste à subdiviser les populations en groupes homogènes par rapport à un facteur (par exemple, sexe, âge, tabagisme). On calcule alors le rapport des risques ou l’odds ratio de chaque strate, puis les moyennes générales pondérées des rapports des risques ou des odds ratios. Ces valeurs globales reflètent l’association entre l’exposition primaire et la maladie après élimination des effets dus au facteur sur lequel s’est fondée la stratification.
Le rapport standardisé des taux (en anglais, SRR, pour Standardized Rate Ratio) est le ratio de deux taux standardisés. En d’autres termes, le SRR est la moyenne pondérée des rapports de taux spécifiques selon la strate, le poids affecté à chaque strate étant la distribution des temps-personnes dans le groupe témoin des non-exposés. Il est possible de comparer les SRR de plusieurs groupes à condition d’employer les mêmes facteurs de pondération. On peut également construire des intervalles de confiance pour les SRR comme pour les rapports des taux.
Le rapport comparatif de mortalité (en anglais, SMR, pour Standardized Mortality Ratio) correspond à la moyenne pondérée des rapports de taux spécifiques selon l’âge, les poids (par exemple les temps-personnes à risque) étant tirés du groupe à l’étude tandis que les taux proviennent de la population témoin, ce qui est l’inverse du SRR. Habituellement, la population témoin est la population générale, dont les taux de mortalité sont souvent faciles à établir et basés sur des grands nombres, ce qui les rend plus stables que les taux correspondant à une cohorte non exposée ou à un sous-groupe de la population professionnelle considérée. On appelle standardisation indirecte l’utilisation des poids de la cohorte au lieu de ceux de la population témoin. Le SMR est le rapport du nombre observé au nombre attendu de décès dans la cohorte, sur la base des taux de la population témoin (pour la notation, ce ratio est par convention multiplié par 100). En l’absence de toute association, le SMR est égal à 100. Il faut noter, parce que les taux sont ceux de la population de référence et les poids, ceux du groupe étudié, que deux SMR (ou plus) ne sont ordinairement pas comparables. On a tendance à l’oublier au moment de l’interprétation de données épidémiologiques, ce qui peut mener à des conclusions erronées.
Il est très fréquent d’observer une mortalité plus basse dans les cohortes professionnelles que dans la population générale, même quand les travailleurs courent un risque accru du fait d’expositions professionnelles. Ce phénomène, dit effet du travailleur bien portant ou effet du travailleur en bonne santé, reflète le fait que tout groupe de personnes actives a, en moyenne, de plus grandes chances d’être en meilleure santé que la population générale, qui comprend à la fois des actifs et des inactifs incapables de travailler par suite d’une maladie ou d’un handicap. Le taux de mortalité tend à être plus élevé dans la population générale que chez les actifs, l’effet variant en intensité selon la cause du décès. Par exemple, il est en général moins important dans le cas du cancer que dans celui des pneumopathies obstructives chroniques. Une des raisons en est que la plupart des cancers ne seraient probablement pas liés à une prédisposition dépendant du choix de métier ou de carrière fait à un plus jeune âge. Dans un groupe donné de travailleurs, l’effet du travailleur bien portant a tendance à diminuer avec le temps.
Il arrive que l’on ne dispose pas des statistiques complètes d’une cohorte (temps-personnes à risque) et que l’on ait seulement des indications sur les décès ou sur certains types de décès au sein de la cohorte (par exemple, décès de retraités et d’actifs, mais non pas de ceux qui ont cessé de travailler avant d’atteindre l’âge de la retraite). Le calcul du nombre d’années-personnes fait alors appel à des méthodes spéciales comprenant l’utilisation des tables d’espérance de vie. En l’absence d’une information complète sur le nombre d’années-personnes correspondant à tous les membres de la cohorte, indépendamment de leur état de santé, il est impossible de calculer les SMR et les SRR. On se sert alors des rapports de mortalité proportionnelle (en anglais, PMR, pour Proportional Mortality Ratio). Le rapport de mortalité proportionnelle est égal au rapport du nombre observé de décès liés à une cause spécifique, au nombre de décès attendu en fonction de la proportion du nombre total de décès dus à la cause spécifique dans la population de référence, multiplié par le nombre total de décès dans le groupe étudié, multiplié par 100.
La proportion de décès toutes causes confondues devant être égale à 1 (PMR = 100), il arrive que certains PMR semblent trop élevés, mais ils sont en fait artificiellement gonflés par suite du déficit réel d’autres causes de décès. De même, certains déficits apparents peuvent en réalité refléter un trop grand nombre de décès liés à d’autres causes. Par exemple, si les opérateurs de pulvérisation aérienne de pesticides ont un réel surnombre de décès par accident, l’exigence mathématique que le PMR toutes causes confondues égale 100 peut entraîner un déficit apparent des décès liés à une cause ou à une autre, alors même que la mortalité est excessive. Pour remédier à ce problème potentiel, les chercheurs qui s’intéressent principalement au cancer peuvent calculer le ratio de mortalité proportionnelle par cancer, c’est le rapport du nombre observé de décès par cancer au nombre attendu, en se basant sur la proportion de décès liés au cancer étudié par rapport à l’ensemble des décès par cancer (au lieu des décès toutes causes confondues) dans la population de référence, multiplié par le nombre total de décès par cancer dans le groupe étudié, multiplié par 100. Ainsi, ce ratio n’est pas touché par une aberration (par excès ou par défaut) dépendant de décès non liés au cancer, comme ceux qui sont dus à des accidents, des maladies cardio-vasculaires ou des pathologies pulmonaires non tumorales.
On peut faire une meilleure analyse des études basées sur les PMR en recourant aux rapports des cotes de mortalité (en anglais, MOR pour Mortality Odds Ratios), qui permettent d’analyser les données comme si elles provenaient d’une étude cas-témoins. Les «témoins» sont constitués par un sous-groupe de l’ensemble des décès que l’on pense sans relation avec l’exposition étudiée. Par exemple, si les chercheurs s’intéressaient principalement au cancer, ils calculeraient les rapports des cotes de mortalité en comparant l’exposition parmi les morts par cancer à l’exposition parmi les morts par maladie cardio-vasculaire. Cette approche, comme celle qui est basée sur le ratio de mortalité proportionnelle par cancer, permet d’éviter les difficultés qui surviennent quand la fluctuation d’une cause de décès se répercute sur le risque apparent d’une autre cause du simple fait que le PMR général doit être égal à 100. Le choix du sous-groupe témoin reste néanmoins critique. Comme nous l’avons dit plus haut, ce sous-groupe doit être sans relation avec l’exposition, mais, dans de nombreuses pathologies pouvant servir de témoin, il se peut que l’existence d’une relation entre exposition et maladie ne soit pas connue.
Certaines mesures expriment la part d’une maladie qui pourrait être attribuée à une exposition si l’association observée était causale. Le risque attribuable chez les exposés (RAe) est le taux de maladie chez les exposés moins le taux chez les non-exposés. Les taux de maladie ne pouvant être directement mesurés dans les études cas-témoins, on ne peut calculer le RAe que dans les études de cohortes. Une mesure apparentée plus intuitive, le risque attribuable pour 100 exposés (RAe%), peut être obtenue dans les deux types d’études. Le RAe% est la proportion des cas survenus dans la population exposée qui est attribuable à l’exposition (voir les formules dans les tableaux 28.3 et 28.4). Le RAe% est égal au rapport des taux (ou le odds ratio) moins 1, divisé par le rapport des taux (ou le odds ratio) puis multiplié par 100.
Le risque attribuable dans la population (RAP) et le pourcentage de risque attribuable dans la population (RAP%) ou fraction étiologique du risque reflètent l’incidence de la maladie dans la population générale (composée de personnes exposées et non exposées), qui serait due à l’exposition si l’association observée était causale. Le RAP peut être obtenu dans des études de cohortes (voir tableau 28.3) tandis que le RAP% peut être calculé dans les deux genres d’études (voir tableaux 28.3 et 28.4).
Nous avons décrit plusieurs mesures de risque. Chacune suppose la mise en œuvre de méthodes pour dénombrer les événements et en évaluer la représentativité au sein d’un groupe défini. Lorsqu’on compare les résultats de différentes études, il est essentiel de comprendre les méthodes utilisées pour être en mesure d’expliquer les différences observées.
L’épidémiologiste s’intéresse aux relations entre variables, principalement les variables d’exposition et d’effet. En général, il veut déterminer si l’apparition d’une maladie est liée à la présence d’un agent particulier dans la population (exposition). Les façons d’étudier ces relations peuvent varier considérablement. On peut essayer de trouver toutes les personnes exposées à cet agent et les suivre pour mesurer l’incidence de la maladie, puis comparer cette incidence à celle qui caractérise une population non exposée adéquate. Une autre façon de procéder consiste simplement à prendre des échantillons parmi les sujets exposés et les autres, sans les dénombrer complètement. On peut, dans une troisième option, rechercher toutes les personnes qui développent une maladie donnée dans un laps de temps défini (les cas) et choisir un groupe adéquat de sujets bien portants (un échantillon de la population source des cas), puis établir si les schémas d’exposition diffèrent dans les deux groupes. Le suivi des participants est une possibilité (dans les études dites longitudinales): dans ce cas, il y a un décalage de temps entre l’exposition et l’apparition de la maladie. On peut enfin réaliser une étude transversale de la population, c’est-à-dire mesurer tant l’exposition que la maladie à un moment donné.
Nous nous intéressons dans cet article aux trois méthodologies de base: l’étude de cohorte, l’étude cas-témoins et l’étude transversale. Pour illustrer le propos, prenons le cas d’une grande usine de rayonne viscose dans une petite ville. On décide d’y entreprendre une étude pour savoir si l’exposition au sulfure de carbone augmente le risque de maladies cardio-vasculaires. Plusieurs plans d’étude sont possibles; certains sont évidents, d’autres le sont moins. La première stratégie consiste à recenser tous les travailleurs qui ont été exposés au disulfure de carbone et à les suivre sur le plan de la mortalité cardio-vasculaire.
L’étude de cohorte porte sur des participants qui ont en commun un même événement, l’exposition. Une étude classique de cohortes se base sur un groupe défini de personnes exposées, chacune étant suivie pour inscription des taux de morbidité ou de mortalité. A part l’exposition qualitative commune, il est également souhaitable de définir la cohorte par d’autres critères d’admissibilité — classe d’âge, sexe (masculin, féminin ou les deux), durée et intensité minimales d’exposition, absence de toute autre exposition — afin d’augmenter la validité de l’étude et son efficacité. A l’entrée dans l’étude, tous les membres de la cohorte devraient être exempts de la maladie étudiée, selon l’ensemble empirique de critères utilisés pour mesurer celle-ci.
Dans l’étude par cohorte des effets du sulfure de carbone sur la morbidité coronarienne, par exemple, si la coronaropathie est définie par l’infarctus clinique, les sujets qui, au départ, ont présenté des épisodes d’infarctus du myocarde doivent être exclus de la cohorte. Par contre, des sujets présentant des anomalies électrocardiographiques sans infarctus peuvent être retenus. Toutefois, si l’apparition de nouvelles modifications électrocardiographiques constitue le marqueur empirique d’effet, il faut que les membres de la cohorte aient également des électrocardiogrammes normaux à l’entrée.
La morbidité (mesurée par l’incidence) ou la mortalité d’une cohorte exposée doit être comparée à celle d’une cohorte de référence qui, idéalement, devrait être aussi semblable que possible à la cohorte exposée dans tous ses aspects pertinents, à l’exception de l’exposition, afin de déterminer le risque relatif de maladie ou de décès dû à l’exposition. Il est préférable de disposer d’une cohorte semblable non exposée comme groupe témoin plutôt que de comparer, comme on le fait souvent à tort, le taux de morbidité ou de mortalité de la cohorte exposée à des taux nationaux standardisés selon l’âge, parce que la population générale ne remplit pas les conditions nécessaires à une comparaison valide, même les plus élémentaires d’entre elles. Le rapport comparatif de mortalité ou de morbidité (SMR) découlant d’une telle comparaison entraîne habituellement une sous-estimation du risque relatif vrai, car un biais dans la cohorte exposée invalide la comparabilité des deux populations. Ce biais de comparaison est appelé «effet du travailleur en bonne santé». En fait, il s’agit non pas vraiment d’un «effet», mais d’un biais de confusion négative dû au roulement basé sur la santé qui se produit dans une population de travailleurs (les personnes de santé précaire tendent à s’exclure spontanément des cohortes «exposées» ou à n’y jamais entrer et finissent bien souvent par grossir les rangs des chômeurs dans la population générale).
Parce qu’une cohorte «exposée» est définie comme ayant une certaine exposition, seuls les effets de cette exposition (ou association d’expositions) peuvent être étudiés simultanément. Par ailleurs, l’étude de cohorte permet d’étudier plusieurs pathologies en même temps. Il est également possible d’étudier concurremment différentes manifestations de la même maladie, par exemple l’angine de poitrine, les modifications électrocardiographiques, l’infarctus clinique du myocarde et la mortalité coronarienne. Tout en étant bien adaptée pour tester des hypothèses spécifiques (par exemple, «l’exposition au sulfure de carbone provoque une coronaropathie»), l’étude de cohorte apporte également des réponses à une question plus générale: «Quelles sont les maladies provoquées par cette exposition?».
Par exemple, dans une étude de cohorte portant sur le risque pour les fondeurs de mourir d’un cancer du poumon, les données de mortalité sont tirées du registre national des causes de décès. Bien que l’étude vise à déterminer si les émanations de fonderie provoquent le cancer du poumon, la source de données donne également, pour le même investissement, l’information sur toutes les autres causes de décès. Ainsi, d’autres risques peuvent être étudiés en même temps.
L’étude de cohorte peut être soit rétrospective (historique) soit prospective (active). Dans les deux cas, la structure de l’étude est la même. Un dénombrement complet de la population exposée est réalisé à un moment ou à une période donnée, et l’effet est mesuré pour tous les individus à une date finale définie. La différence entre l’étude rétrospective et l’étude prospective réside dans la période considérée: dans le premier cas, la date finale est déjà passée; dans le second, elle se situe à l’avenir.
Dans le plan rétrospectif, la cohorte est définie à un certain moment du passé (par exemple, les travailleurs exposés le 1er janvier 1961 ou ceux qui ont été embauchés à des postes exposés entre 1961 et 1970). La morbidité ou la mortalité de tous les membres de la cohorte est alors suivie jusqu’au présent. Bien que le terme «tous» sous-entende qu’il faut retrouver ceux qui ont cessé de travailler, il est rare en pratique d’atteindre une couverture à 100%. Toutefois, plus le suivi est complet, plus l’étude est valide.
Dans le modèle prospectif, la cohorte est définie au présent ou pour une période future et la morbidité est alors suivie dans le futur.
Dans les études de cohortes, il faut prévoir un temps de suivi suffisant pour permettre aux événements considérés de se manifester. Il arrive que l’on ne puisse disposer que des dossiers historiques d’une période brève du passé; il n’en reste pas moins souhaitable de tirer parti de cette source de données, car on aura alors besoin d’une période relativement courte de suivi prospectif avant que les résultats ne soient disponibles. Dans ce cas, un plan d’étude combiné rétrospectif et prospectif peut être efficace. Le tableau 28.5 illustre un mode de présentation générale des tableaux de fréquence des données de cohorte.
|
Composante du taux de maladie |
Cohorte exposée |
Cohorte non exposée |
|
Cas de pathologie ou de décès |
c1 |
c0 |
|
Nombre de personnes dans la cohorte |
N1 |
N0 |
La proportion observée de malades dans la cohorte «d’exposés» est ainsi calculée:
et pour la cohorte de référence:
Le rapport des mesures du risque (risque relatif RR) est alors exprimé ainsi:
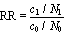
N0 et N1 sont habituellement exprimés en années-personnes, plutôt qu’en simples nombres de personnes membres des populations. Les années-personnes sont calculées pour chaque individu séparément. En effet, il arrive souvent que différentes personnes entrent dans la cohorte pour une certaine période, mais pas nécessairement à la même date. De ce fait, leur suivi commence à des dates différentes. De même, après un décès ou après la survenue d’un événement particulier, la personne en cause ne fait plus partie de la «population à risque» et ne doit plus compter dans les années-personnes du dénominateur.
Si RR (le risque relatif) est supérieur à 1, la morbidité de la cohorte exposée est supérieure à celle de la cohorte de référence et vice versa. RR est une estimation ponctuelle pour laquelle il faut calculer l’intervalle de confiance (IC). Plus l’étude est grande, plus l’IC sera étroit. Si RR = 1 n’est pas inclus dans l’IC (par exemple, IC 95% compris entre 1,4 et 5,8), le résultat peut être considéré comme «statistiquement significatif» au niveau de probabilité choisi (dans cet exemple, α = 0,05).
Si la population générale est prise comme population de référence, c0 est remplacé par la valeur «attendue» E(c1), tirée des taux de morbidité ou de mortalité ajustés selon l’âge de cette population (c’est-à-dire, le nombre de cas qui seraient survenus dans la cohorte en l’absence de l’exposition considérée). On obtient ainsi le rapport comparatif de morbidité ou de mortalité ou SMR. Donc,
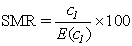
Pour le SMR également, l’intervalle de confiance doit être calculé. Dans une publication, cette mesure est préférable à une valeur de p, car le test de signification statistique n’a pas de sens si la population générale sert de référence. Une telle comparaison fait intervenir un biais considérable (l’effet du travailleur en bonne santé mentionné plus haut), sans compter que le test de signification statistique initialement développé pour la recherche expérimentale aboutit à un résultat erroné en présence d’une erreur systématique.
Supposons que la question posée soit de savoir si la poussière de quartz cause le cancer du poumon. Habituellement, la poussière de quartz est présente avec d’autres substances cancérogènes comme les produits de filiation du radon et les gaz d’échappement de moteurs diesel dans les mines ou les hydrocarbures polyaromatiques dans les fonderies. Par ailleurs, les carrières de granit n’exposent pas les travailleurs de la pierre à ces substances cancérogènes. Par conséquent, il est préférable d’étudier le problème chez les travailleurs des carrières de granit.
Supposons maintenant que les 2 000 ouvriers ayant travaillé dans vingt carrières entre 1951 et 1960 soient inclus dans la cohorte et que l’incidence du cancer (voire uniquement la mortalité) soit suivie à partir de dix ans après la première exposition (pour laisser un temps d’induction) jusqu’en 1990. Cela représente une période de vingt à trente ans (selon l’année de l’entrée dans la cohorte) soit, en moyenne, un suivi de la mortalité (morbidité) sur vingt-cinq ans chez les 1 000 travailleurs des carrières qui travaillaient spécifiquement sur le granit. L’historique de l’exposition de chaque membre de la cohorte doit être consigné. Il faut donc rechercher ceux qui ont quitté les carrières pour dresser l’historique de leur exposition ultérieure. Dans les pays où les habitants ont un numéro unique d’enregistrement, il s’agit d’une procédure simple, principalement régie par les lois nationales de protection des données. En l’absence d’un tel système de suivi, il peut être extrêmement difficile de retrouver les travailleurs. Lorsqu’il existe des registres de décès ou de maladies, le taux de mortalité toutes causes confondues, pour tous les cancers ou tous les cancers spécifiques, peut être tiré du registre national de causes de décès (pour la mortalité par cancer, le registre national du cancer est une meilleure source parce qu’il contient des diagnostics plus fins et permet d’obtenir des données d’incidence ou de morbidité). Les taux de décès (ou les taux d’incidence du cancer) peuvent être comparés aux «nombres attendus» calculés à partir des taux nationaux utilisant comme base les années-personnes de la cohorte exposée.
Supposons que l’on dénombre 70 cas de décès par cancer du poumon dans la cohorte alors que le nombre attendu (c’est-à-dire le nombre qui serait apparu en l’absence d’exposition) est de 35. Alors:
c1 = 70, E (c1) = 35
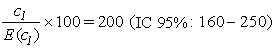
Ainsi, SMR = 200, ce qui signifie que les sujets exposés courent un risque deux fois plus grand que les autres de mourir d’un cancer du poumon. Si les circonstances détaillées de l’exposition sont connues, la mortalité par cancer peut être étudiée en fonction de différents critères: temps de latence (10, 15, 20 ans), travail dans différents types de carrières (variétés de granit), différentes périodes, différentes intensités d’exposition, etc. Toutefois, on ne peut pas répartir 70 cas entre de trop nombreuses catégories, car le nombre compris dans chacune deviendrait rapidement trop petit pour permettre des analyses statistiques appropriées.
Les deux types de plans d’étude de cohorte présentent des avantages et des inconvénients. En général, l’étude rétrospective ne permet de mesurer que la mortalité parce que les données des manifestations plus légères de la maladie manquent souvent. Les registres de cancer sont une exception, avec peut-être quelques autres, comme les registres d’accidents vasculaires cérébraux et les registres de sortie des hôpitaux, dans lesquels on trouve aussi des données d’incidence. L’évaluation de l’exposition antérieure est toujours difficile et les données d’exposition sont en général le point faible des études rétrospectives. Ces facteurs peuvent masquer l’effet. D’un autre côté, comme les cas sont déjà survenus, l’étude peut aboutir à des résultats beaucoup plus rapidement, peut-être en deux ou trois ans.
Une étude prospective de cohorte peut être mieux planifiée pour répondre aux besoins du chercheur et assurer une collecte précise et systématique des données d’exposition. On peut mesurer diverses manifestations de la maladie, répéter les mesures de l’exposition et de l’effet, standardiser toutes les mesures et en contrôler la validité. Néanmoins, si la maladie a une longue période de latence (c’est le cas du cancer), un long délai — parfois vingt à trente ans — s’écoulera avant que l’on ait des résultats. Beaucoup de choses peuvent se passer pendant ce temps: départ des chercheurs, amélioration des techniques de mesure de l’exposition, réaménagement ou fermeture des sites choisis pour l’étude et ainsi de suite. Tous ces facteurs peuvent compromettre le succès du suivi. De plus, les études prospectives sont souvent plus coûteuses, mais cette différence est surtout due au nombre plus élevé de mesures (contrôle répété des expositions, examens cliniques, etc.) plutôt qu’à une différence dans le prix d’enregistrement des décès. Autrement dit, le prix par unité d’information ne dépasse pas nécessairement celui d’une étude rétrospective. Bref, les études prospectives sont mieux adaptées aux maladies à temps de latence assez court, qui exigent un suivi de courte durée, tandis que celles de nature rétrospective sont préférables pour les maladies ayant une longue période de latence.
Reprenons le cas de l’usine de rayonne viscose. Une étude rétrospective de cohorte peut être impossible si les listes de travailleurs exposés ont été perdues et une étude prospective de cohorte ne donnera des résultats utiles qu’après une longue attente. On pourrait alors envisager de comparer les décès par maladies coronariennes survenus dans la ville dans une période donnée aux décès enregistrés dans un échantillon de la population générale se situant dans la même tranche d’âge.
L’étude classique cas-témoins est basée sur l’échantillonnage dans une population dynamique (ouverte, caractérisée par un renouvellement de ses membres). Cette population peut être celle d’un pays, d’une province ou d’une municipalité (comme dans notre exemple); il peut également s’agir de la population, définie sur une base administrative, dans laquelle se recrutent les patients admis dans un hôpital. La population définie fournit à la fois les cas et les témoins.
La technique consiste à réunir tous les cas de la maladie en question qui existent à un moment donné (cas prévalents) ou qui sont survenus dans un laps de temps défini (cas incidents). Les détails des cas peuvent ensuite être extraits des registres de morbidité ou de mortalité ou être recueillis directement auprès des hôpitaux ou d’autres sources ayant des informations diagnostiques validées. Les témoins sont un échantillon de la même population, extrait soit parmi ceux qui ne sont pas atteints de la maladie (non-cas) soit de la population entière. Il est également possible de sélectionner comme témoins des personnes présentant une autre pathologie; il faut alors que ces patients soient représentatifs de la population à laquelle les cas appartiennent. On peut avoir un ou plusieurs témoins pour chaque cas. L’approche par échantillonnage s’écarte de la méthodologie des études de cohortes, qui s’intéressent à l’ensemble d’une population. Il va sans dire que les études cas-témoins sont bien moins coûteuses, mais il est important que l’échantillon soit représentatif de la population entière dont les cas sont issus («base d’étude»), faute de quoi l’étude pourrait être biaisée.
Une fois les cas et les témoins identifiés, il faut déterminer l’historique de leur exposition à l’aide de questionnaires ou d’entrevues ou, parfois, en consultant différents documents (par exemple, dossiers de paie à partir desquels on peut déduire les antécédents professionnels). Les données sont recueillies auprès des participants eux-mêmes ou, s’ils sont décédés, auprès de leurs proches parents. Pour assurer une remémoration symétrique, il est important que les proportions de morts et de survivants soient égales dans les groupes de cas et de témoins. En effet, l’historique de l’exposition est souvent moins détaillé quand il est obtenu de proches plutôt que des participants eux-mêmes. Le profil d’exposition des cas est alors comparé à celui des témoins, donnant ainsi une estimation de l’odds ratio (OR), mesure indirecte du risque chez les sujets exposés de contracter la maladie par rapport à celui des sujets non exposés.
L’étude cas-témoins dépendant de l’historique d’exposition des patients atteints d’une certaine maladie (les cas) comparativement à un échantillon de sujets non malades (les témoins) extraits de la même population, l’association soupçonnée ne peut être vérifiée que pour une seule maladie. En revanche, ce type de plan d’étude permet d’enquêter concurremment sur les effets de plusieurs expositions différentes ou de polyexpositions. L’étude cas-témoins est bien adaptée à des questions de recherche spécifiques (par exemple: «L’exposition au sulfure de carbone cause-t-elle des coronaropathies?»), mais elle peut aussi aider à répondre à la question plus générale: «Quelles sont les expositions susceptibles de provoquer cette maladie?».
La question de savoir si l’exposition à des solvants organiques induit un cancer primitif du foie se pose en Europe (par exemple). C’est dans un registre national du cancer que l’on peut le plus facilement retrouver les cas de cancer primitif du foie, maladie comparativement rare en Europe. Supposons que tous les cas de cancer survenant durant trois ans constituent les cas. L’étude consisterait donc en un suivi de trois ans de la population entière du pays européen concerné. Les témoins, échantillon de personnes exemptes de cancer du foie, sont choisis au sein de la même population. Pour des raisons de commodité (la même source étant utilisée pour échantillonner les témoins), des patients atteints d’un autre type de cancer, sans relation avec les solvants, peuvent servir de témoins. Des sujets atteints de cancer du côlon, qui n’a aucun lien connu avec l’exposition aux solvants, peuvent donc être inclus dans les témoins (l’emploi de cancéreux comme témoins minimise le biais de remémoration, étant donné que la précision de l’historique dressé par les cas et les témoins est en moyenne comparable. Toutefois, si un lien, inconnu au début de l’étude, entre le cancer du côlon et l’exposition aux solvants était démontré par la suite, ce type de témoins entraînerait une sous-estimation du risque réel, non une surestimation).
Pour chaque cas de cancer du foie, deux témoins sont prélevés pour assurer une plus grande puissance statistique (il serait même possible d’en prendre davantage, mais le coût peut constituer un obstacle. Si on n’est pas limité par des contraintes budgétaires, le chiffre optimal se situe à quatre témoins. Au-delà de quatre, la loi des rendements décroissants s’applique). Après avoir obtenu l’autorisation des autorités chargées de la protection des données, on se met en rapport avec les cas et les témoins, ou des membres de leur famille, le plus souvent au moyen d’un questionnaire postal demandant un historique détaillé de la carrière avec, en particulier, une liste chronologique des employeurs, des services d’affectation, des fonctions exécutées aux différents postes et du temps passé dans chaque affectation. On peut généralement obtenir ces données des proches parents au prix de quelques difficultés; ces derniers ne se souviennent en général pas bien des noms chimiques ou des noms commerciaux des produits utilisés. Il est également souhaitable que le questionnaire porte sur d’éventuels facteurs de confusion, comme la consommation d’alcool, l’exposition à des produits alimentaires contenant des aflatoxines ou une contamination éventuelle par le virus de l’hépatite B ou C. Afin d’avoir un taux de réponse suffisamment élevé, deux lettres de rappel sont envoyées aux non-répondants à trois semaines d’intervalle, ce qui permet souvent d’obtenir un taux de réponse final supérieur à 70%. Les antécédents professionnels sont ensuite examinés par un hygiéniste industriel ne sachant pas si les sujets sont des cas ou des témoins, qui fait un classement de l’exposition aux solvants: haute, moyenne, basse, nulle ou inconnue. Les dix années d’exposition précédant immédiatement le diagnostic du cancer ne sont pas prises en compte parce qu’il n’est pas biologiquement plausible que les substances cancérogènes initiatrices puissent avoir causé le cancer dans un laps de temps aussi court (même si en fait les promoteurs en sont capables). A ce stade, il est également possible de distinguer différents types d’exposition aux solvants. Le fait de disposer d’antécédents professionnels complets permet d’explorer d’autres expositions qui n’étaient pas nécessairement prévues dans les hypothèses initiales. Des odds ratios peuvent ainsi être calculés pour l’exposition à n’importe quel solvant, à des solvants spécifiques ou à des mélanges de solvants, ou encore pour différentes catégories d’intensité d’exposition et pour différentes périodes de temps en relation avec le diagnostic de cancer. Il est prudent d’exclure de l’analyse tous les cas dont l’exposition est inconnue.
Les cas et les témoins peuvent être échantillonnés et analysés soit comme des séries indépendantes soit comme des groupes appariés. L’appariement consiste à sélectionner des témoins correspondant à chaque cas sur la base d’une ou de plusieurs caractéristiques ou attributs, de façon à former des paires (ou des jeux, lorsque plusieurs témoins sont choisis pour chaque cas). L’appariement est généralement réalisé sur la base d’un ou de plusieurs facteurs comme l’âge, le statut vital (vivant ou décédé), les antécédents de tabagisme, la chronologie du diagnostic, etc. Dans notre exemple, les cas et les témoins sont appariés selon l’âge et le statut vital (le choix du statut vital comme facteur est important parce que les patients eux-mêmes donnent habituellement un historique d’exposition plus précis que les proches et que la symétrie est essentielle à la validité). On recommande aujourd’hui de limiter l’appariement, qui peut introduire une confusion négative (effet de masque).
Si un témoin est apparié à un cas, l’étude est dite à paires appariées. Si les considérations financières ne l’empêchent pas, la sélection de plus d’un témoin par cas améliore la stabilité de l’estimation de l’odds ratio, ce qui rend la taille de l’étude plus efficiente.
Le tableau 28.6 illustre le mode de présentation des résultats d’une étude cas-témoins non appariée.
|
|
Classification d’exposition |
|
|
|
Exposés |
Non-exposés |
|
Cas |
c1 |
c0 |
|
Non-cas |
n1 |
n0 |
De ce tableau, on peut calculer les taux d’exposition des cas et de la population (les témoins), puis les diviser pour obtenir l’odds ratio (OR) de l’exposition. Le taux d’exposition égale c1/c0 pour les cas et n1/n0 pour les témoins. L’estimation de l’odds ratio est donc:
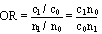
Si relativement plus de cas que de témoins ont été découverts, l’OR est supérieur à 1 et vice versa. Les intervalles de confiance doivent être calculés et donnés pour l’OR, de la même manière que pour le RR.
Pour prendre un exemple complémentaire, considérons un centre de médecine du travail d’une grande entreprise qui suit 8 000 travailleurs exposés à diverses poussières et autres agents chimiques. Nous nous intéressons à la relation entre l’exposition à ces poussières et la bronchite chronique. L’étude comprend le suivi de cette population pendant une année. Nous avons pris comme critère diagnostic de bronchite chronique «la toux matinale avec expectoration de sécrétions bronchiques pendant trois mois durant deux années consécutives». Les critères «positifs» de l’exposition aux poussières sont définis avant l’étude. Tout patient consultant le centre de médecine du travail et remplissant ces critères durant une période d’une année est un cas et le patient suivant, venu pour avis médical sur des problèmes non pulmonaires, est défini comme un témoin. Supposons que 100 cas et 100 témoins ont été inclus durant la période d’investigation. Posons que 40 cas et 15 témoins sont classés comme ayant été exposés aux poussières. Alors,
c1 = 40, c0 = 60, n1 = 15, et n0 = 85.
Par conséquent,
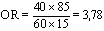
Dans cet exemple, nous n’avons porté aucune attention à la possibilité d’intervention de facteurs de confusion, qui provoqueraient une distorsion de l’OR par suite de différences systématiques entre les cas et les témoins pour une variable comme l’âge. L’une des façons de réduire ce biais est d’apparier témoins et cas sur l’âge ou sur d’autres facteurs soupçonnés. Les résultats sont présentés dans le tableau 28.7.
|
Cas |
Référents |
|
|
|
Exposition (+) |
Exposition (-) |
|
Exposition (+) |
f+ + |
f+ - |
|
Exposition (-) |
f- + |
f- - |
L’analyse se concentre sur les paires discordantes: autrement dit, les paires «cas exposé, témoin non exposé» ( f+ –) et les paires «cas non exposé, témoin exposé» ( f– +). Quand les deux membres d’une paire sont exposés ou non exposés, la paire n’est pas prise en compte. L’odds ratio dans une étude à paires appariées est défini comme suit:
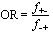
Dans une étude sur l’association entre le cancer des voies nasales et l’exposition à la poussière de bois, il y avait au total 164 paires de cas-témoins. Pour une paire seulement, le cas et le témoin avaient été exposés et dans 150 paires, ni les cas ni les témoins ne l’avaient été. Ces paires n’ont pas été prises en compte. Le cas, mais pas le témoin, avait été exposé dans 12 paires, et le témoin mais non pas le cas, dans une paire. Ainsi,
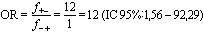
Comme l’unité est absente de cet intervalle, le résultat est statistiquement significatif: autrement dit, il existe une association statistiquement significative entre le cancer des fosses nasales et l’exposition à la poussière de bois.
Les études cas-témoins sont plus efficaces que les études de cohortes quand la maladie est rare; en fait, elles constituent parfois le seul choix qui s’offre. Cependant, les maladies courantes peuvent également être étudiées grâce à cette méthode. Si l’exposition est rare, une cohorte basée sur l’exposition peut être préférable, quand ce n’est pas la seule méthode épidémiologique envisageable. Bien sûr, des études de cohortes peuvent aussi être employées pour des expositions courantes. Le choix entre cohortes et cas-témoins quand l’exposition et la maladie sont courantes se fait généralement sur la base des conditions de validité.
Comme les études cas-témoins s’appuient sur des données d’exposition rétrospectives, habituellement basées sur la mémoire des participants, leur point faible est le manque de précision et la grossièreté de l’information sur l’exposition, qui entraîne un masquage d’effet par erreur de classement non différentielle (symétrique) du statut d’exposition. En outre, il arrive parfois que la remémoration soit asymétrique entre les cas et les témoins, les cas se souvenant souvent «mieux» des faits (c’est le biais de remémoration ou biais de rappel). La remémoration sélective peut entraîner un biais d’amplification d’effet par erreur de classement différentielle (asymétrique) de l’exposition. Les avantages des études cas-témoins résident dans leur rapport coût-efficacité et dans leur capacité de résoudre un problème dans un laps de temps relativement court. Du fait de la stratégie d’échantillonnage, elles permettent d’élargir l’investigation à une très grande tranche de population (par exemple, grâce aux registres nationaux du cancer) renforçant ainsi la puissance statistique des résultats. Dans les pays où les lois sur la protection des données ou le manque de registres adéquats de population et de morbidité empêchent la réalisation d’études de cohortes, les études cas-témoins en milieu hospitalier peuvent constituer le seul moyen pratique de réaliser une recherche épidémiologique.
Une étude de cohorte peut également être conçue pour comprendre un échantillonnage au lieu d’un suivi complet. Ce type de protocole a déjà été appelé étude cas-témoins «emboîtée», «par emboîtement» ou «hiérarchique». Une approche par échantillonnage impose plusieurs conditions d’admissibilité, car les comparaisons sont faites à l’intérieur de la même cohorte. Celle-ci doit, par conséquent, inclure non seulement des travailleurs fortement exposés, mais aussi d’autres faiblement exposés et même des sujets non exposés pour assurer des contrastes d’exposition. Il est important d’assurer cette diversité des critères d’admissibilité lors de la constitution de la cohorte. Si une analyse complète est d’abord effectuée sur une cohorte dont les critères d’admissibilité étaient une forte exposition et qu’une étude cas-témoins hiérarchique est ensuite menée sur la même cohorte, l’étude perd toute sensibilité. Ce procédé entraîne un masquage d’effet, car les contrastes d’exposition sont insuffisants par suite du manque de variabilité dans l’exposition des membres de la cohorte.
Toutefois, pourvu que la cohorte présente une large gamme d’expositions, l’approche cas-témoins hiérarchique est très intéressante. On prend tous les cas apparaissant dans la cohorte pendant la période de suivi pour former la série des cas, mais on ne fait que prélever un échantillon de non-cas pour former la série des témoins. Ensuite, comme dans l’étude classique cas-témoins, les chercheurs recueillent des informations détaillées sur l’exposition en interrogeant les cas et les témoins (ou leurs proches), en examinant les dossiers des services du personnel, en établissant la matrice emplois-exposition ou en combinant deux ou plusieurs de ces méthodes. Les témoins peuvent soit être appariés aux cas, soit être traités comme une série indépendante.
L’échantillonnage peut être moins coûteux que la recherche exhaustive d’information sur chaque membre de la cohorte. En particulier, comme on n’étudie qu’un échantillon de témoins, on peut consacrer plus de ressources à l’évaluation détaillée et précise de chaque cas et de chaque témoin. Toutefois, comme dans les études classiques de cohortes, on se heurte aux mêmes problèmes de puissance statistique. Pour atteindre une puissance statistique satisfaisante, la cohorte doit comporter un nombre «adéquat» de cas exposés, selon l’importance du risque à déceler.
Au sens strict, l’étude transversale examine une coupe transversale de la population, sans tenir compte du temps, mesurant l’exposition et la morbidité (prévalence) d’une manière ponctuelle.
D’un point de vue étiologique, ce type d’étude est peu fiable, en partie parce qu’il traite de la prévalence par opposition à l’incidence. La prévalence est une mesure composite, dépendant à la fois de l’incidence et de la durée de la maladie, ce qui limite en outre l’emploi des études transversales aux pathologies de longue durée. De plus, le fait que les sujets très sensibles aux effets de l’exposition soient exclus du groupe exposé crée un fort biais négatif. Les considérations étiologiques favorisent par conséquent les études longitudinales. En fait, les études transversales ne permettent même pas de déterminer d’une manière concluante si l’exposition a précédé la maladie ou l’inverse. L’étude transversale n’est étiologiquement significative que s’il existe une vraie relation temporelle entre l’exposition et l’événement, ce qui revient à dire que l’exposition doit avoir des effets immédiats. Cependant, l’exposition peut être mesurée transversalement de façon à représenter une certaine période écoulée (comme dans le cas de la plombémie) alors que la mesure d’effet exprime une prévalence (par exemple, la vitesse de conduction nerveuse). L’étude comprend alors à la fois un plan longitudinal et un plan transversal et ne se limite pas à une coupe transversale de la population.
Les enquêtes transversales sont souvent utiles dans un but pratique et administratif plutôt que scientifique. Les principes épidémiologiques peuvent être appliqués à des activités de surveillance systématique de médecine du travail, comme:
Il est important de choisir des indicateurs représentatifs, valides et spécifiques de la morbidité pour tous les types d’enquêtes. Une enquête ou un programme de dépistage peut n’utiliser qu’un petit nombre de tests, à l’inverse des diagnostics cliniques; c’est la raison pour laquelle la valeur prédictive du test de dépistage est importante. Des méthodes peu sensibles peuvent ne pas détecter la maladie considérée tandis que des méthodes très sensibles peuvent produire trop de résultats faussement positifs. Il n’est pas utile de dépister des maladies rares dans un contexte professionnel. Toutes les activités de découverte de cas (c’est-à-dire de dépistage) nécessitent un système de prise en charge des personnes qui présentent des résultats positifs, sur le plan à la fois diagnostique et thérapeutique, faute de quoi, il n’en résulte que des frustrations pouvant faire plus de mal que de bien.
L’épidémiologie a pour but d’étudier la maladie dans des populations données. Elle peut servir, en particulier, à mieux comprendre les origines professionnelles d’une détérioration de l’état de santé. L’épidémiologie se fonde sur des études permettant de comparer des groupes de personnes atteintes d’une maladie à d’autres groupes qui n’en souffrent pas. Les études peuvent également consister à examiner quelles sont les maladies des personnes qui exercent certaines professions comportant des expositions particulières, puis à comparer ces profils de maladie à ceux de personnes qui ne subissent pas les mêmes expositions. Ces études aboutissent à des estimations du risque de contracter une maladie dans des conditions d’exposition spécifiques. De toute évidence, ces estimations doivent être valides pour que l’information obtenue puisse servir à établir des programmes de prévention, à reconnaître les maladies professionnelles et à en assurer la réparation.
La validité d’une étude peut se définir par sa capacité de refléter l’état réel des choses. Par conséquent, une étude est jugée valide si elle mesure correctement l’association (positive, négative ou nulle) entre une exposition et une maladie. Une étude valide décrit la direction et la valeur d’un risque réel. La validité peut être interne ou externe. La validité interne correspond à la capacité de refléter réellement ce qui s’est passé parmi les sujets de l’étude, tandis que la validité externe reflète ce qui pourrait survenir dans l’ensemble de la population.
La validité exprime la véracité d’une mesure. Elle se distingue de la précision de la mesure, qui est fonction de la taille de l’étude et de l’efficacité du plan d’étude adopté.
Une étude est dite valide sur le plan interne quand elle est exempte de tout biais et reflète véritablement l’association entre l’exposition et la maladie parmi les participants. Un risque de maladie, observé en association avec une exposition, peut en effet résulter d’une réelle association et donc être valide, mais il peut également refléter l’influence de divers biais. Un biais donnera une image déformée de la réalité.
On distingue en général trois principaux types de biais, également appelés erreurs systématiques:
Nous les présentons brièvement ci-dessous, avec des exemples tirés du domaine de la santé au travail.
Le biais de sélection se produit quand le choix des participants à une étude est influencé par la connaissance de leur statut d’exposition. Ce problème se pose donc quand la maladie est déjà présente au moment où la personne entre dans l’étude. En épidémiologie, c’est d’ordinaire ce qui se passe pour les études cas-témoins ou les études de cohortes rétrospectives: une personne est plus susceptible d’être choisie comme cas si l’on sait qu’elle a été exposée. Trois ensembles de circonstances peuvent mener à une situation de ce genre, qui dépendra en outre de la gravité de la maladie.
Ce type de biais peut survenir quand des personnes, qui savent qu’elles ont été exposées par le passé à des produits nocifs ou soupçonnés de l’être et qui sont convaincues que leur maladie est due à l’exposition, consultent un médecin pour des symptômes dont d’autres personnes, non exposées, n’auraient pas tenu compte. C’est particulièrement le cas pour les maladies paucisymptomatiques, comme l’avortement spontané chez les infirmières manipulant des traitements anticancéreux. Ces femmes sont plus averties que les autres de la physiologie de la reproduction et parce qu’elles craignent de ne pas avoir d’enfants, elles sont plus susceptibles de reconnaître ou de penser reconnaître un avortement spontané à des symptômes que d’autres femmes tiendraient pour un simple retard des règles. Un autre exemple, tiré d’une étude rétrospective de cohorte citée par Rothman (1986), concerne une enquête des Centres de lutte contre la maladie des Etats-Unis (Centers for Disease Control (CDC)) portant sur la leucémie parmi les soldats ayant assisté à un essai nucléaire dans le Nevada. Parmi les soldats présents sur le site de cet essai, 76% ont été sélectionnés et ont constitué la cohorte. De ce nombre, 82% avaient été choisis par les enquêteurs et 18% s’étaient, de leur propre initiative, mis en rapport avec ceux-ci après avoir entendu parler de l’étude. Quatre cas de leucémie ont été découverts parmi les 82% contactés et quatre autres parmi les 18% qui avaient eux-mêmes offert de participer à l’étude. Cet exemple montre bien que, parmi les chercheurs, la capacité d’identifier les personnes exposées était liée au risque de leucémie.
Le biais de diagnostic se produit quand les médecins sont plus susceptibles de diagnostiquer une maladie donnée lorsqu’ils savent à quoi le patient a été exposé précédemment. Par exemple, quand la plupart des peintures étaient à base de plomb, l’un des symptômes d’une maladie des nerfs périphériques, la névrite périphérique avec paralysie, était également connu sous le nom de «goutte du poignet» ou de «main tombante» du peintre. Il est plus facile de faire un diagnostic, même à un stade très précoce, lorsqu’on connaît la profession du patient, alors que l’identification de l’agent causal aurait été beaucoup plus difficile chez des participants dont l’exposition professionnelle au plomb ne serait pas connue.
Quand des personnes, malades ou en bonne santé, sont invitées à participer à une étude, plusieurs facteurs interviennent dans leur décision d’accepter ou de refuser. L’intérêt personnel qu’elles portent au problème déterminera dans quelle mesure elles sont disposées à répondre à des questionnaires plus ou moins longs ou encore à se soumettre à une prise de sang ou au prélèvement d’autres échantillons biologiques. Une personne qui sait qu’elle a pu être exposée sera plus encline à participer à l’enquête dans l’espoir que l’on trouvera la cause de sa maladie, tandis qu’une autre qui ne croit pas avoir été exposée à une substance dangereuse ou qui ne tient pas à le savoir, déclinera l’invitation. Cela aboutit à la sélection des personnes qui veulent bien participer plutôt que de celles qui auraient pu l’être.
Ce biais, également appelé biais d’observation, se rattache aux effets de la maladie dans les études de cohortes et à l’évaluation de l’exposition dans les études cas-témoins.
Deux groupes sont définis au début de l’étude, l’un exposé et l’autre non exposé. Des problèmes de biais de diagnostic apparaîtront si la recherche des cas diffère dans les deux groupes. Considérons, par exemple, une cohorte de personnes exposées à une fuite de dioxine dans une branche d’activité donnée. Pour le groupe le plus exposé, un système de suivi actif est mis en place avec examens médicaux et surveillance biologique à intervalles réguliers, tandis que les autres travailleurs font l’objet d’une prise en charge de routine. Il est très probable dans cette situation que l’on arrive à déceler un plus grand nombre de cas de maladie dans le groupe sous surveillance étroite, ce qui peut entraîner une surestimation du risque.
Le phénomène inverse peut survenir dans les études rétrospectives de cohortes. Dans ces études, on fait en général des recherches dans les dossiers de toutes les personnes qui ont été employées dans une branche donnée afin d’évaluer la maladie ou la mortalité consécutive à l’emploi. Malheureusement, dans la plupart des études, les dossiers sont incomplets et un dossier manquant peut correspondre soit à un cas d’exposition, soit à un cas de maladie, soit aux deux. Par exemple, dans une étude menée dans l’industrie chimique sur des travailleurs exposés à des amines aromatiques, huit tumeurs ont été trouvées dans un groupe de 777 sujets chez qui un dépistage cytologique de tumeurs urinaires avait été réalisé. Pour tous ces cas, seuls trente-quatre dossiers manquaient, correspondant à 4,4% de la population exposée. En revanche, par rapport aux cas de cancer de la vessie, les données d’exposition manquaient pour deux d’entre eux sur huit malades, soit 25% des sujets. On peut en conclure que les dossiers des personnes devenues des cas sont plus susceptibles d’être perdus que les dossiers des autres travailleurs, probablement par suite d’un plus grand nombre de mutations au sein de l’entreprise (peut-être reliées aux effets de l’exposition), de démissions, de licenciements ou par simple effet du hasard.
Dans les études cas-témoins, la maladie est déjà présente au début de l’étude et on recherche l’information sur les expositions survenues dans le passé. Les biais résultent soit de l’attitude des enquêteurs, soit de celle des participants à l’égard de l’étude. L’information est en général recueillie par des enquêteurs qui peuvent ou non être au courant des hypothèses de la recherche. Par exemple, dans une étude cas-témoins du cancer de la vessie menée dans une zone très industrialisée, l’équipe d’enquêteurs peut très bien savoir que certains produits chimiques, comme les amines aromatiques, sont des facteurs de risque pour le type de cancer considéré. S’ils savent de surcroît quels sujets ont ou n’ont pas développé la maladie, ils auront probablement des entretiens plus approfondis avec les participants atteints du cancer qu’avec les témoins. Ils peuvent insister pour obtenir des informations détaillées concernant les professions antérieures et rechercher systématiquement l’exposition aux amines aromatiques, tandis qu’ils se limiteront à enregistrer d’une manière plus courante les différentes fonctions exécutées par les témoins. Le biais qui en découle est appelé biais de suspicion d’exposition.
Si ce sont les participants qui sont responsables de ce genre de biais, on l’appelle biais de remémoration par opposition au biais de l’enquêteur. Les deux biais partagent le mécanisme commun de la suspicion d’exposition. Soupçonnant une origine professionnelle de leur maladie, les personnes malades tenteront de se souvenir le plus précisément possible de tous les agents dangereux auxquels elles ont pu être exposées. En cas de manipulation de produits non définis, elles peuvent être amenées à se remémorer des noms précis de substances chimiques, en particulier quand une liste de produits suspects leur est montrée. Les témoins sont moins susceptibles d’emprunter le même cheminement de pensée.
On dit qu’il existe des facteurs de confusion quand l’association observée entre l’exposition et la maladie résulte en partie de l’effet combiné de l’exposition considérée et d’un autre facteur. Par exemple, ayant noté une augmentation du risque de cancer pulmonaire chez les soudeurs, nous pourrions être tentés de conclure immédiatement à l’existence d’une relation de cause à effet entre l’exposition aux fumées de soudage et le cancer du poumon. Cependant, nous savons aussi que le tabagisme est de loin le principal facteur de risque dans le cancer du poumon. Par conséquent, si l’information est disponible, nous commencerons par vérifier le niveau de consommation de tabac chez les soudeurs et chez les autres participants à l’étude. Il se peut que les soudeurs soient plus exposés au tabagisme que les non-soudeurs. Dans cette situation, nous devons tenir compte du fait que le tabagisme est associé à la fois au cancer du poumon et au métier de soudeur. En épidémiologie, on dit que, par suite de sa double association, le tabagisme introduit un facteur de confusion dans l’association entre le soudage et le cancer du poumon.
Contrairement aux phénomènes abordés plus haut — sélection, information et confusion, qui sont des biais —, l’interaction est due non à des défauts du plan d’étude ou de l’analyse, mais simplement à la réalité et à sa complexité. Considérons l’exemple suivant: l’exposition au radon est, comme le tabagisme, un facteur de risque pour le cancer du poumon. En outre, tabagisme et radon ont des effets différents sur le risque de cancer pulmonaire selon qu’ils agissent indépendamment ou concurremment. La plupart des études professionnelles réalisées à ce sujet ont porté sur des mineurs de fond et ont, à l’occasion, abouti à des résultats contradictoires. Dans l’ensemble, les indices recueillis portent à croire qu’il existe une interaction entre le tabac et le radon dans l’induction du cancer du poumon. Cela signifie que l’exposition au radon augmente le risque de cancer, même chez les non-fumeurs, mais que ce risque est beaucoup plus grand chez les fumeurs que chez les non-fumeurs. Les épidémiologistes disent que l’effet est multiplicatif. A l’inverse de la confusion, l’interaction doit être soigneusement étudiée et décrite dans l’analyse, plutôt que d’être simplement contrôlée, car elle reflète ce qui se passe au niveau biologique et n’est pas la simple conséquence d’une insuffisance méthodologique dans la conception de l’étude. Sa compréhension mène à une interprétation plus valide des conclusions de l’étude.
L’aspect de la validité externe ne peut être abordé que si l’on est sûr de la validité interne de l’étude. Si l’on est convaincu que les résultats observés reflètent des associations réelles, on peut alors se demander s’il est possible de les extrapoler pour les appliquer à l’ensemble de la population dans laquelle les participants ont été choisis, voire à d’autres populations identiques ou au moins très semblables. La question la plus courante est de savoir si les résultats obtenus chez les hommes sont applicables aux femmes. Pendant des années, les études telles que les enquêtes épidémiologiques en santé au travail étaient menées exclusivement parmi les hommes. Les études portant sur les chimistes réalisées entre 1960 et 1970 aux Etats-Unis, au Royaume-Uni et en Suède ont toutes montré une augmentation des risques de certains cancers spécifiques, particulièrement la leucémie, le lymphome et le cancer du pancréas. Compte tenu des connaissances que nous avions des effets de l’exposition aux solvants et à quelques autres produits chimiques, nous pouvions déjà à cette époque déduire que le travail en laboratoire comportait également un risque de cancer pour les femmes. Cette hypothèse s’est confirmée lors de la publication, vers le milieu des années quatre-vingt, de la première étude portant sur des femmes chimistes, qui aboutissait à des résultats similaires à ceux obtenus chez les hommes. Il faut noter que, parmi les surincidences constatées, il y avait des tumeurs du sein et de l’ovaire, que l’on avait toujours exclusivement rattachées auparavant à des facteurs endogènes ou à la reproduction, mais dans lesquelles des facteurs environnementaux nouvellement suspectés, comme les pesticides, pouvaient jouer un rôle. De nombreux autres travaux seront nécessaires pour préciser les causes professionnelles du cancer chez la femme.
S’il est évident que l’on ne réalisera jamais une étude parfaitement valide, il n’en incombe pas moins au chercheur d’éviter ou, du moins, de minimiser le plus de biais possibles. C’est en général au stade de la conception du plan que l’on peut le faire dans les meilleures conditions, mais il est également possible d’intervenir en cours d’analyse.
Les biais de sélection et d’information ne peuvent être évités qu’au prix d’une conception soigneuse du plan de l’étude épidémiologique, de l’application scrupuleuse et quotidienne de toutes les recommandations et d’une attention méticuleuse à l’assurance qualité, pour sa réalisation sur le terrain. Les facteurs de confusion peuvent être contrôlés au stade de la conception du plan ou à celui de l’analyse.
Les critères de sélection d’un participant dans le groupe des cas doivent être explicitement définis. On ne peut pas ou, du moins, on ne devrait pas essayer d’étudier des conditions cliniques mal définies. Pour minimiser l’effet de la connaissance de l’exposition sur l’évaluation de la maladie, on peut par exemple n’inclure que les cas graves qui auraient été diagnostiqués quelle que soit l’information sur les antécédents du patient. Dans le domaine du cancer, les études sont souvent limitées aux cas comportant une preuve histologique, afin d’éviter d’inclure les lésions à la limite de la malignité. Cela signifie aussi que les groupes étudiés doivent être bien définis. Par exemple, il est bien connu en épidémiologie du cancer que les tumeurs comprenant plusieurs types histologiques pour un organe donné peuvent avoir des facteurs de risque différents. Si le nombre de cas est suffisant, il est préférable de séparer les adénocarcinomes du poumon des carcinomes à cellules squameuses. Quels que soient les critères définitifs de sélection, ils doivent toujours être clairement définis et bien décrits. Par exemple, le code exact de la maladie doit être indiqué à l’aide de la Classification internationale des maladies (CIM) et, dans le cas des cancers, de la Classification internationale des maladies-oncologie (CIM-O).
Une fois les critères définis, il faut essayer de maximiser la participation à l’étude. Comme le refus de participer est rarement dû au hasard, il introduit des biais. Les études doivent avant tout être présentées aux cliniciens qui suivent les malades. Leur approbation est nécessaire pour avoir accès à ces derniers; il faut donc les persuader de soutenir l’étude. On peut souvent gagner leur adhésion en leur expliquant que celle-ci vise à améliorer la santé publique. Toutefois, il est préférable à ce stade de ne pas discuter des hypothèses exactes devant être évaluées pour éviter de les influencer indûment. Il n’est pas souhaitable de demander aux médecins d’assumer des tâches supplémentaires; il est en effet plus facile de les convaincre de prêter leur concours si l’on a prévu des moyens pour prendre en charge toutes les tâches supplémentaires reliées à l’étude. Les enquêteurs et les responsables de l’abstraction des données ne doivent pas connaître l’état de santé des sujets dont ils sont chargés.
La même attention doit être portée aux renseignements donnés aux participants. Le but de l’étude doit être décrit en termes généraux et neutres, qui soient en même temps convaincants et persuasifs. Il est important que les participants comprennent bien les questions de confidentialité et l’intérêt de l’étude pour la santé publique, mais on prendra soin d’éviter le jargon médical. Dans la majorité des cas, il n’est pas indiqué de proposer de rémunérer les participants ou de leur offrir d’autres avantages incitatifs, mais il faudrait les dédommager s’ils ont à engager des frais. Enfin, la population choisie devrait posséder des connaissances scientifiques suffisantes pour comprendre l’importance de l’étude. Les avantages et les risques de la participation doivent être expliqués à chaque participant éventuel à qui on demande de remplir des questionnaires ou de consentir au prélèvement d’échantillons biologiques à conserver ou à analyser. Aucune pression ou contrainte ne doit s’exercer, le consentement obtenu devant être libre, éclairé et préalable. Si l’étude se base exclusivement sur des dossiers, il faut obtenir l’accord préalable des organismes compétents. Dans ces circonstances, le consentement individuel n’est en général pas nécessaire pourvu que l’on ait l’approbation des instances syndicales et gouvernementales. Les études épidémiologiques ne menacent pas la vie privée des individus, leur objectif étant d’améliorer la santé de la population. On aura d’habitude besoin, avant d’entreprendre une telle étude, d’obtenir l’approbation d’une commission officielle (ou d’un comité d’éthique), qui voudra sans doute examiner la plupart des éléments énumérés ci-dessus avant de donner son consentement.
Dans les études prospectives de cohortes, les moyens d’évaluation de la maladie ou de la mortalité doivent être identiques pour les sujets exposés et non exposés. En particulier, il n’est pas souhaitable d’utiliser des sources différentes d’information, par exemple en faisant des recherches dans un registre central de mortalité pour les participants non exposés et en exerçant une surveillance active et intensive des participants exposés. De même, la cause du décès doit être obtenue par des moyens strictement comparables. Cela signifie que, si l’on puise dans des documents officiels les renseignements concernant la population non exposée, qui est souvent la population générale, on ne doit jamais envisager d’obtenir des informations plus précises sur le sous-groupe des exposés en consultant des dossiers médicaux ou en interrogeant des participants ou des membres de leur famille.
Dans les études de cohortes rétrospectives, des efforts doivent être déployés pour déterminer la comparabilité de la population étudiée et de la population générale. Il convient d’être attentif aux différences de pertes de sujets entre les groupes exposés et non exposés en recourant à diverses sources d’information sur la composition de la population. Par exemple, il peut être utile de comparer les listes de paie aux listes d’affiliation syndicale ou à d’autres listes professionnelles. Il faut alors pouvoir expliquer les différences et suivre étroitement le protocole adopté pour l’étude.
Dans les études cas-témoins, on peut recourir à d’autres moyens pour éviter les biais. Les enquêteurs, le personnel administratif et les participants ne devraient pas connaître les hypothèses précises de l’étude. S’ils ignorent l’association à tester, ils seront moins enclins à essayer de fournir la réponse attendue. Toutefois, il est souvent impossible de ne pas informer le personnel de l’hypothèse de recherche à tester. Les enquêteurs connaîtront presque toujours les expositions les plus importantes et sauront qui sont les cas et les témoins. Il faut donc pouvoir compter sur leur intégrité et leur connaissance de la méthodologie de recherche fondamentale, qui doit faire partie de leur formation professionnelle, l’objectivité étant de rigueur à tous les niveaux dans le domaine scientifique.
Il est plus facile de ne pas informer les participants du but exact de la recherche. De bonnes explications de base fondées sur la nécessité de recueillir des données pour mieux comprendre la santé et la maladie sont souvent suffisantes et répondront adéquatement aux exigences des comités d’éthique.
Les facteurs de confusion sont les seuls biais dont on puisse s’occuper soit au stade de la conception du plan d’étude, soit au stade de l’analyse, pourvu que l’on dispose de renseignements suffisants. Par exemple, si l’on considère que l’âge est le facteur de confusion potentiel de l’association étudiée parce qu’il est relié au risque de maladie (le cancer devenant plus fréquent avec l’âge) et à l’exposition (les conditions d’exposition varient avec l’âge ou avec des facteurs qui y sont liés comme les titres de compétence, le poste occupé ou l’ancienneté), plusieurs solutions existent. La plus simple est de limiter l’étude à un groupe d’âge particulier, par exemple les hommes blancs âgés de quarante à cinquante ans. On obtiendra ainsi des éléments suffisants pour une analyse simple, mais on risque aussi de limiter l’application des résultats à un seul groupe sexe-âge-race. Une autre solution consiste à apparier les sujets selon l’âge, c’est-à-dire à faire correspondre à chaque cas un témoin du même âge. C’est une idée séduisante, mais il ne faut pas perdre de vue la difficulté qu’il y aurait à former des paires si le nombre de facteurs à apparier augmente. De plus, une fois le facteur apparié, il devient impossible d’évaluer son rôle dans l’apparition de la maladie. La dernière solution consiste à avoir dans la base de données suffisamment d’informations pertinentes sur les facteurs de confusion potentiels pour être en mesure de les vérifier au stade de l’analyse. Cela peut être fait soit par une simple analyse stratifiée, soit à l’aide d’outils plus perfectionnés comme l’analyse multivariée. Toutefois, il est utile de rappeler qu’aucune analyse ne pourra racheter une étude mal conçue ou mal organisée.
On connaît depuis longtemps le risque que représentent les biais en recherche épidémiologique. On s’en inquiétait relativement peu quand les associations à étudier étaient étroites (comme dans le cas du tabac et du cancer du poumon) et qu’une certaine imprécision ne posait pas de problème trop grave. Toutefois, maintenant qu’il faut évaluer des facteurs de risque moins tranchés, il est crucial de disposer de meilleurs outils, dont une conception adéquate du plan d’étude et la possibilité d’associer les avantages de différents modèles traditionnels d’enquêtes — études cas-témoins ou de cohortes — dans le cadre d’approches plus innovantes comme les études cas-témoins hiérarchiques. L’utilisation de marqueurs biologiques peut également permettre d’obtenir des évaluations plus précises des expositions présentes et peut-être passées, ainsi que des premiers stades de la maladie.
Les erreurs de mesure de l’exposition peuvent, selon leur distribution, avoir différents effets sur la relation exposition-maladie étudiée. Quand une étude épidémiologique a été menée en aveugle (c’est-à-dire sans connaître l’état de santé des participants), on s’attend à ce que les erreurs de mesure soient réparties de manière uniforme parmi les strates de sujets malades et en bonne santé.
Le tableau 28.8 présente un exemple: supposons que l’on constitue une cohorte de personnes exposées professionnellement à un produit toxique, dans le but de faire une recherche sur une pathologie fréquente. On détermine le niveau d’exposition au moment du recrutement (T0), mais non aux stades ultérieurs du suivi. Supposons, cependant, que le nombre de personnes exposées change l’année suivante: en T1, 250 des 1 200 sujets initialement exposés cessent de l’être et, en même temps, 150 des 750 sujets non exposés commencent à être exposés au produit toxique. Ainsi, en T1, 1 100 individus sont exposés et 850 ne le sont pas. En conséquence, il y a un classement erroné de l’exposition basé sur la mesure initiale du statut d’exposition en T0. Les personnes en question sont ensuite retrouvées vingt ans plus tard (en T2) et le risque cumulé de maladie est évalué (l’exemple se fonde sur l’hypothèse que seule une exposition de plus d’un an présente un intérêt).
|
|
Temps |
||
|
|
T0 |
T1 |
T2 |
|
Travailleurs exposés |
1 200 |
250 cessent d’être exposés |
1 100 |
|
Cas de maladie en T2 = 220 parmi les travailleurs exposés |
|||
|
Travailleurs non exposés |
750 |
50 commencent à être exposés |
850 |
|
Cas de maladie en T2 = 85 parmi les travailleurs non exposés |
|||
|
Le vrai risque de maladie en T2 est de 20% parmi les travailleurs exposés (220/1 100), et de 10% chez les travailleurs non exposés (85/850) |
|||
|
Le risque estimé de maladie en T2 parmi les personnes classées comme exposées en T0 = 20% (vrai risque exposés) x 950 + 10% |
|||
|
Le risque estimé de maladie en T2 parmi les personnes classées comme non exposées en T0: = 20% (vrai risque exposés) x 150 +10% |
|||
|
Risque relatif estimé = 17,9% / 12% = 1,49 |
|||
Dans cet exemple, l’erreur de classement dépend davantage du plan d’étude et des caractéristiques de la population que des limites techniques des mesures d’exposition. L’effet de l’erreur est tel que le «vrai» rapport de 2,0 entre le risque cumulé des personnes exposées et non exposées devient un rapport «observé» de 1,49 (voir tableau 28.8). Cette sous-estimation du risque relatif découle du «masquage» de la relation entre l’exposition et la maladie, qui se produit, comme dans ce cas, quand l’erreur de classement de l’exposition est uniformément distribuée parmi les sujets malades et en bonne santé (la mesure de l’exposition n’étant pas influencée par le fait que le sujet est atteint ou non de la maladie considérée).
Par contre, l’association peut aussi bien être surestimée que sous-estimée si l’erreur de classement de l’exposition n’est pas uniformément distribuée. Dans l’exemple, nous pourrions avoir des biais en sus du masquage de la relation causale, si le classement de l’exposition dépendait de l’état pathologique des travailleurs. Cela aurait pu survenir, par exemple, si l’on avait décidé de recueillir des échantillons biologiques dans un groupe de travailleurs exposés et un groupe de non-exposés afin de déceler aux premiers stades tout changement dû à l’exposition professionnelle. Les échantillons provenant des travailleurs exposés auraient ensuite été soumis à des analyses beaucoup plus poussées que ceux des sujets non exposés et la curiosité scientifique aurait pu amener les chercheurs à mesurer d’autres marqueurs biologiques chez les exposés (adduits à l’ADN dans les lymphocytes ou marqueurs urinaires d’atteinte oxydative de l’ADN, par exemple) en partant du principe que ces personnes sont scientifiquement «plus intéressantes». Il s’agit là d’une attitude assez courante qui peut pourtant introduire de sérieux biais.
Le rôle de la statistique dans les recherches épidémiologiques sur les relations causales fait l’objet de nombreux débats. En épidémiologie, la statistique est pour l’essentiel un ensemble de méthodes d’évaluation de données portant sur des populations humaines (ou animales). C’est aussi, en particulier, une technique de quantification et de mesure de phénomènes incertains. Toutes les investigations scientifiques qui ont trait à des aspects indéterminés ou variables de la réalité peuvent tirer profit de la méthode statistique. En épidémiologie, la variabilité est intrinsèque à l’unité d’observation: une personne n’est pas une entité déterminée. Bien qu’il soit possible d’améliorer les plans d’étude en les adaptant aux hypothèses statistiques concernant les variations aléatoires, des raisons éthiques et pratiques rendent cette approche peu usitée. L’épidémiologie s’est plutôt engagée dans la recherche observationnelle qui comporte des sources de variabilité aussi bien aléatoires que systématiques.
La théorie statistique s’intéresse au contrôle de la variabilité non structurée des données pour qu’il soit possible de tirer des conclusions valides à partir d’observations empiriques. En l’absence d’une explication de la variabilité du phénomène étudié, la statistique le suppose aléatoire, c’est-à-dire soumis à des variations non systématiques par rapport à un état moyen naturel (pour une critique raisonnée de ces hypothèses, voir Greenland, 1990).
La science se fonde sur des faits empiriques pour tenter de démontrer que ses modèles théoriques de phénomènes naturels ont une certaine validité. En fait, les méthodes empruntées à la théorie statistique déterminent à quel degré les observations du monde réel sont conformes à la vision qu’ont les scientifiques du phénomène exprimé par un modèle mathématique. Les méthodes statistiques basées sur les mathématiques doivent donc être soigneusement choisies, car d’innombrables exemples confirment que «l’on fait dire ce que l’on veut aux statistiques». C’est pourquoi les épidémiologistes doivent vérifier le bien-fondé des techniques qu’ils appliquent pour mesurer le risque de maladie. Ils doivent, en particulier, apporter un grand soin à l’interprétation des résultats statistiquement significatifs et non significatifs.
Le premier sens du terme statistique se rapporte à une mesure synthétique calculée à partir d’un jeu de valeurs. Des statistiques ou indices descriptifs tels que la moyenne arithmétique, la médiane ou le mode sont largement utilisés pour résumer l’information contenue dans une série d’observations. Dans le passé, ces indicateurs synthétiques étaient employés à des fins administratives par les Etats, d’où leur appellation de statistiques. Les statistiques épidémiologiques les plus courantes découlent de comparaisons inhérentes à la nature de l’épidémiologie, qui pose des questions telles que: «telle population est-elle plus exposée que telle autre à une maladie donnée?». Dans ces comparaisons, le risque relatif, qui mesure la puissance de l’association entre une caractéristique particulière et la probabilité de tomber malade, est le plus communément employé en recherche étiologique. Le risque attribuable est également une mesure d’association entre des facteurs individuels et le risque de maladie, mais il met davantage l’accent sur le nombre de cas évités grâce à une intervention qui supprime les facteurs en question. Ce type de risque est surtout employé dans les domaines de la santé publique et de la médecine préventive.
Le deuxième sens du terme statistique est en rapport avec les techniques et la théorie sous-jacente de l’inférence statistique. Il s’agit là d’une forme particulière de la logique inductive qui définit les règles d’une généralisation valide des résultats tirés d’une série particulière d’observations empiriques. Cette généralisation n’est valide que si l’on respecte certaines hypothèses. Cela nous amène au second cas où une utilisation non réfléchie des statistiques peut induire en erreur: en épidémiologie d’observation, il est très difficile d’être certain des hypothèses qu’impliquent les techniques statistiques. Il est donc essentiel que toute analyse de données repose sur des études de sensibilité et des estimateurs solides. De plus, les conclusions finales devraient se baser sur une connaissance globale du sujet et ne pas dépendre exclusivement des résultats de tests d’hypothèses statistiques.
L’unité statistique est l’élément sur lequel portent les observations empiriques. Il peut s’agir d’une personne, d’un échantillon biologique ou d’un fragment de matière première à analyser. En général, les unités statistiques sont choisies indépendamment par le chercheur, mais ce n’est pas toujours le cas. Par exemple, dans les études longitudinales, une série d’observations peut être réalisée sur un groupe de personnes pendant une certaine période. Dans ce cas, les unités statistiques sont les séries d’observations, qui sont non pas indépendantes, mais structurées par leurs liaisons respectives à chaque personne étudiée. L’absence d’indépendance ou la corrélation entre les unités statistiques mérite une attention particulière en analyse statistique.
Une variable est une caractéristique mesurée sur une unité statistique donnée. Il importe de la distinguer de la constante, caractéristique individuelle fixe. Par exemple, dans une étude faite sur des sujets humains, le fait pour un participant d’avoir une tête ou un thorax est une constante alors que son sexe est une variable.
Les variables sont évaluées à l’aide d’échelles de mesure qui peuvent être qualitatives ou quantitatives. Les variables qualitatives décrivent des modalités ou des catégories différentes. Quand les modalités ne peuvent pas être classées ou ordonnées les unes par rapport aux autres (par exemple, la couleur des cheveux ou le sexe), la variable est dite nominale. Si les catégories peuvent être ordonnées (degrés de gravité d’une maladie), la variable est dite ordinale. Si une variable a une valeur numérique, on dit que l’échelle est quantitative. Une échelle quantitative est dite discrète si la variable ne peut avoir que quelques valeurs définies (par exemple, des nombres entiers pour exprimer le nombre de cas d’une maladie). Les mesures qui s’expriment en nombres réels forment une échelle continue. Les échelles continues sont dites d’intervalle quand leur valeur nulle a un sens purement conventionnel, le zéro ne correspondant pas à une quantité nulle: par exemple, une température de 0º Celsius ne désigne pas une énergie thermique nulle. Dans ce cas, seules les différences entre les valeurs ont un sens (d’où l’emploi de l’expression «échelle d’intervalle»). Quand la valeur nulle est réelle, l’échelle est dite de rapport. Sur une telle échelle, les rapports entre les grandeurs ont un sens, un rapport double signifiant deux fois la quantité. Par exemple, dire qu’un corps a une température deux fois plus élevée qu’un autre signifie qu’il a deux fois l’énergie thermique, à condition que la température soit mesurée sur une échelle de rapport (par exemple, en degrés Kelvin). L’ensemble des valeurs permises d’une variable est appelé le domaine de la variable.
La statistique a pour objectif de généraliser en partant d’une série d’observations particulières. Cette série de mesures empiriques est appelée échantillon. A partir d’un échantillon, on calcule diverses données statistiques descriptives qui résument l’information recueillie.
Pour caractériser une série de mesures, on a en général besoin de connaître sa tendance centrale et sa variabilité. Le choix parmi plusieurs options dépend de l’échelle employée pour mesurer un phénomène et du but dans lequel les statistiques sont établies. Le tableau 28.9 présente différentes mesures de la tendance centrale et de la variabilité (ou dispersion) et les associe à l’échelle de mesure appropriée.
|
Indices |
Définition |
Echelle de mesure |
||
|
|
|
Qualitative |
Quantitative |
|
|
|
|
Nominale |
Ordinale |
Intervalle/ rapport |
|
Moyenne arithmétique |
Somme des valeurs observées divisée par le nombre d’observations |
|
|
x |
|
Médiane |
Milieu de la distribution observée |
|
x |
x |
|
Mode |
Valeur la plus fréquente |
x |
x |
x |
|
Intervalle |
Domaine délimité par les valeurs minimale et maximale de la distribution |
|
x |
x |
|
Variance |
Somme des carrés des écarts à la moyenne divisée par le nombre d’observations moins 1 |
|
|
x |
Les statistiques descriptives calculées sont appelées estimations quand elles sont substituées aux valeurs correspondantes de la population dans laquelle l’échantillon a été extrait, ces valeurs étant elles-mêmes des constantes appelées paramètres. Des estimations d’un même paramètre peuvent être obtenues par des méthodes statistiques différentes. Une estimation doit être valide et précise.
Le paradigme de l’échantillon de population implique que la validité peut être assurée par la façon dont l’échantillon est extrait de la population. L’échantillonnage randomisé ou probabiliste est la stratégie usuelle: si chaque membre de la population a la même probabilité d’être inclus dans l’échantillon, alors, en moyenne, celui-ci sera représentatif de la population et toute déviation par rapport aux prévisions peut être expliquée par le hasard. La probabilité d’un écart donné par rapport aux prévisions peut également être calculée à condition que l’échantillonnage soit randomisé. Le même type de raisonnement s’applique aux estimations calculées pour l’échantillon en regard des paramètres de la population. Prenons par exemple la moyenne arithmétique de l’échantillon comme une estimation de la valeur moyenne pour la population. Toute différence entre la moyenne de l’échantillon et celle de la population est attribuée aux fluctuations aléatoires de la procédure de tirage au sort des membres de l’échantillon. Nous pouvons calculer la probabilité de n’importe quelle valeur de cette différence pourvu que l’échantillon ait été tiré au hasard. Si l’écart entre l’estimation de l’échantillon et le paramètre de la population ne peut pas être expliqué par le hasard, l’estimation est dite biaisée. Le plan de l’observation ou du modèle expérimental assure la validité des estimations et le paradigme statistique fondamental est celui de l’échantillonnage randomisé.
En médecine, un autre paradigme est adopté lorsque l’étude consiste en une comparaison entre différents groupes. Un exemple type est l’essai clinique contrôlé: une série de patients ayant des caractéristiques similaires est sélectionnée sur la base de critères définis à l’avance. On ne s’inquiète pas de la représentativité à ce stade. Chaque patient inclus dans l’essai est affecté au hasard au groupe de traitement — qui recevra la thérapie standard et le nouveau médicament à évaluer — ou au groupe témoin — qui recevra la thérapie standard et un placebo. Dans ce plan expérimental, la répartition au hasard des patients entre les deux groupes remplace le tirage au sort des membres de l’échantillon. L’estimation de la différence entre les deux groupes peut être évaluée statistiquement, car, dans l’hypothèse de l’inefficacité du nouveau médicament, il est possible de calculer la probabilité de toute différence non nulle.
En épidémiologie, on ne peut pas former au hasard des groupes exposés et non exposés de personnes. Dans ce cas, nous pouvons encore employer des méthodes statistiques comme si les groupes analysés avaient été choisis ou répartis au hasard. L’exactitude de cette hypothèse dépend principalement du plan d’étude. Ce point particulièrement important met en évidence la priorité du plan d’étude sur les techniques statistiques en recherche biomédicale.
L’expression variable aléatoire désigne une variable dont chaque valeur a une probabilité donnée de se produire. Les modèles théoriques de la distribution de la probabilité d’une variable aléatoire sont des modèles de population. L’équivalent pour un échantillon est représenté par la distribution de fréquence de l’échantillon. C’est là un moyen utile de représenter une série de données sur un plan cartésien, avec la variable d’intérêt le long de l’axe horizontal et la fréquence absolue ou relative le long de l’axe vertical. Un graphique permet de voir facilement les valeurs les plus fréquentes et la concentration de la distribution autour de certaines valeurs centrales telles que la moyenne arithmétique.
Pour les variables aléatoires et leur distribution de probabilité, on utilise les termes de paramètres, espérance mathématique (plutôt que moyenne arithmétique) et variance. Ces modèles théoriques décrivent la variabilité d’un phénomène donné. En théorie de l’information, le signal est représenté par la tendance centrale (par exemple, la valeur moyenne) alors que le bruit est mesuré par un indice de dispersion (comme la variance).
Pour illustrer l’inférence statistique, nous utiliserons le modèle binomial. Dans les sections qui suivent, nous aborderons les notions d’estimation ponctuelle, d’intervalle de confiance, de test d’hypothèse, de probabilité de décisions erronées et de puissance d’une étude.
En recherche biomédicale et épidémiologique, la distribution binomiale est le modèle le plus important de variation stochastique. Elle repose sur le fait que la plupart des phénomènes se comportent comme une variable nominale à deux catégories: par exemple, présence/absence de maladie, vivant/mort ou guéri/malade. Dans ces circonstances, nous nous intéressons à la probabilité de succès de l’événement étudié (présence de maladie, vivant ou guéri) et aux facteurs ou variables qui peuvent la modifier. Posons n = 3 travailleurs et supposons que nous soyons intéressés par la probabilité, π, d’une baisse de l’acuité visuelle (oui/non). Le résultat de notre observation est l’une des possibilités présentées dans le tableau 28.10.
|
Travailleur |
Probabilité |
|||||
|
A |
B |
C |
|
|||
|
0 |
0 |
0 |
(1- π)(1- π)(1- π) |
|||
|
1 |
0 |
0 |
π (1- π)(1- π) |
|||
|
0 |
1 |
0 |
(1- π) π (1- π) |
|||
|
0 |
0 |
1 |
(1- π)(1- π) π |
|||
|
0 |
1 |
1 |
(1- π) π π |
|||
|
1 |
0 |
1 |
π (1- π) π |
|||
|
1 |
1 |
0 |
π π (1- π) |
|||
|
1 |
1 |
1 |
π π π |
|||
La probabilité de chacune de ces associations d’événements est facilement obtenue en considérant que π, la probabilité (individuelle) de succès, est constante pour chaque sujet et indépendante des autres événements. Comme nous nous intéressons au nombre total de succès et non pas à une séquence particulière, nous pouvons réarranger le tableau comme suit (voir tableau 28.11) et, en généralisant, exprimer la probabilité P(x) d’avoir x succès sous la forme suivante:
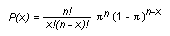
x étant le nombre de succès et x! la factorielle de x, c’est-à-dire, x! = x·(x–1)·(x–2)…·1.
|
Nombre de succès |
Probabilité |
|
0 |
(1-π)3 |
|
1 |
3π (1-π)2 |
|
2 |
3π2 (1-π) |
|
3 |
π3 |
Quand on considère l’événement «être/ne pas être malade», la probabilité π se rattache à l’état dans lequel le sujet est censé être; en épidémiologie, cette probabilité est appelée «prévalence». Pour estimer π, on utilise la proportion d’échantillon:
(1)
qui a pour variance:
(2)
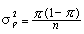
Dans une hypothétique série infinie d’échantillons recopiés de même taille n, nous obtiendrions différentes proportions d’échantillons p = x/n avec des probabilités données par la formule binomiale. La «vraie» valeur de π est estimée pour chaque proportion d’échantillon et un intervalle de confiance de π, c’est-à-dire sa gamme de valeurs vraisemblables, compte tenu des données observées et d’un niveau de confiance défini au préalable (disons 95%), est estimé à partir de la distribution binomiale: c’est la gamme de valeurs de π qui donne une probabilité de x supérieure à une valeur préétablie (disons 2,5%). Pour une expérience hypothétique dans laquelle seraient observés x = 15 succès dans n = 30 essais, la probabilité estimée de succès est:
L’intervalle de confiance à 95% de π, obtenu dans le tableau 28.12, est 0,334 - 0,666. Chaque entrée du tableau montre la probabilité de x = 15 succès dans n = 30 essais, calculée à l’aide de la formule binomiale; par exemple, pour π = 0,30, nous obtenons:
(3)
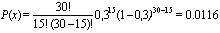
|
π |
Probabilité |
|
0,200 |
0,0002 |
|
0,300 |
0,0116 |
|
0,334 |
0,025 |
|
0,400 |
0,078 |
|
0,500 |
0,144 |
|
0,600 |
0,078 |
|
0,666 |
0,025 |
|
0,700 |
0,0116 |
Si n est grand et p proche de 0,5, nous pouvons utiliser une approximation basée sur la distribution de Gauss:
(4)
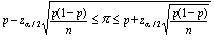
où zα/2 est la valeur de la distribution standard de Gauss pour une probabilité
(5)
1 – α étant l’intervalle de confiance choisi. Dans l’exemple considéré, p = 15/30 = 0,5; n = 30 et dans la table de Gauss z0,025 = 1,96. L’intervalle de confiance à 95% compris entre 0,321 - 0,679 est obtenu en substituant p = 0,5; n = 30 et z0,025 = 1,96 dans l’équation de Gauss ci-dessus. Notons que ces valeurs sont proches des valeurs exactes calculées précédemment.
Les tests statistiques d’hypothèses comprennent une procédure de décision portant sur la valeur d’un paramètre de population. Supposons que, dans l’exemple précédent, on soupçonne qu’il existe un risque élevé de baisse de l’acuité visuelle chez les travailleurs d’une entreprise donnée. L’hypothèse scientifique à tester à l’aide de nos observations empiriques est la suivante: «il existe un risque élevé de baisse de l’acuité visuelle parmi les travailleurs d’une entreprise donnée». Les statisticiens démontrent de telles hypothèses en rejetant l’hypothèse complémentaire, selon laquelle «il n’existe aucune augmentation du risque de baisse de l’acuité visuelle». C’est le principe de la démonstration mathématique par l’absurde: au lieu de prouver une affirmation, on se sert d’une preuve empirique pour rejeter l’affirmation contraire. L’hypothèse statistique est appelée hypothèse nulle. La deuxième étape consiste à préciser la valeur du paramètre de la probabilité de distribution utilisé pour modéliser la variabilité des observations. Dans nos exemples, le phénomène étant binaire (présence/absence d’une baisse de l’acuité visuelle), nous choisissons la distribution binomiale du paramètre π, probabilité de baisse de l’acuité visuelle. L’hypothèse nulle est que π = 0,25. Cette valeur est choisie en fonction des connaissances accumulées sur le sujet et de la connaissance a priori de la prévalence de la baisse de l’acuité visuelle chez les populations non exposées (c’est-à-dire les sujets sans activité professionnelle). Supposons que nos données produisent une estimation p = 0,50, à partir des 30 travailleurs examinés.
Pouvons-nous rejeter l’hypothèse nulle?
Si oui, en faveur de quelle hypothèse alternative?
Nous spécifions une hypothèse alternative à tester si les résultats obtenus imposent de rejeter l’hypothèse nulle. Les hypothèses alternatives non directionnelles (bilatérales) supposent que le paramètre de population est différent de la valeur énoncée dans l’hypothèse nulle; les hypothèses directionnelles (unilatérales) stipulent que le paramètre de la population est plus grand (ou plus petit) que la valeur nulle.
Dans le cadre de l’hypothèse nulle, nous pouvons calculer la distribution des probabilités des résultats de notre exemple. Le tableau 28.13 montre, pour π = 0,25 et n = 30, les probabilités (voir équation (1)) et les probabilités cumulées:
(6)
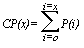
|
X |
Probabilité |
Probabilité cumulée |
|
0 |
0,0002 |
0,0002 |
|
1 |
0,0018 |
0,0020 |
|
2 |
0,0086 |
0,0106 |
|
3 |
0,0269 |
0,0374 |
|
4 |
0,0604 |
0,0979 |
|
5 |
0,1047 |
0,2026 |
|
6 |
0,1455 |
0,3481 |
|
7 |
0,1662 |
0,5143 |
|
8 |
0,1593 |
0,6736 |
|
9 |
0,1298 |
0,8034 |
|
10 |
0,0909 |
0,8943 |
|
11 |
0,0551 |
0,9493 |
|
12 |
0,0291 |
0,9784 |
|
13 |
0,0134 |
0,9918 |
|
14 |
0,0054 |
0,9973 |
|
15 |
0,0019 |
0,9992 |
|
16 |
0,0006 |
0,9998 |
|
17 |
0,0002 |
1,0000 |
|
. |
. |
. |
|
30 |
0,0000 |
1,0000 |
A partir de ce tableau, nous obtenons la probabilité d’avoir x ≥15 travailleurs présentant une baisse de l’acuité visuelle.
Cela signifie qu’il est très improbable d’observer 15 travailleurs ou plus atteints d’une baisse de l’acuité visuelle s’ils suivaient la prévalence de la maladie des populations non exposées. Ainsi, nous pouvons rejeter l’hypothèse nulle et affirmer qu’il y a une plus grande prévalence de baisse de l’acuité visuelle dans la population des travailleurs étudiée.
Si n·π ≥5 et n·(1–π) ≥5, nous pouvons utiliser l’approximation gaussienne:
(7)
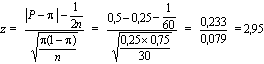
A partir du tableau de la distribution gaussienne standard, nous obtenons:
ce qui correspond de près aux résultats exacts. A partir de cette approximation, nous pouvons voir que la structure fondamentale d’un test statistique d’hypothèse consiste en un rapport signal sur bruit. Dans notre cas, le signal est (p–π), l’écart observé par rapport à l’hypothèse nulle, et le bruit est l’écart-type de P:
(8)
Plus le rapport est grand, plus faible est la probabilité de la valeur nulle π.
En prenant des décisions concernant les hypothèses statistiques, nous risquons deux sortes d’erreurs: l’erreur de type I, qui consiste à rejeter l’hypothèse nulle alors qu’elle est vraie; et l’erreur de type II, qui consiste à accepter l’hypothèse nulle alors qu’elle est fausse. Le niveau de probabilité, ou valeur p, est la probabilité de l’erreur de type I, notée par la lettre grecque α. Elle est calculée à partir de la distribution de la probabilité des observations sous l’hypothèse nulle. Par convention, on définit à l’avance le pourcentage d’erreur α (c’est-à-dire 5% ou 1%) et on rejette l’hypothèse nulle quand le résultat de l’observation a une probabilité égale ou inférieure à ce seuil dit critique.
La probabilité d’une erreur de type II est notée par la lettre grecque β. Pour la calculer, il faut spécifier, dans l’hypothèse alternative, une valeur du paramètre à tester (dans notre exemple, une valeur de π). Les hypothèses alternatives génériques (différent de, supérieur à, inférieur à) ne sont pas utiles. En pratique, c’est la valeur β pour une série d’hypothèses alternatives, ou son complément, la puissance statistique, qui est intéressante. Par exemple, en fixant la valeur de l’erreur α à 5%, nous trouvons à partir du tableau 28.13:
sous l’hypothèse nulle π = 0,25. Si nous avions observé au moins x = 12 succès, nous rejetterions l’hypothèse nulle. Les valeurs correspondantes de β et de la puissance pour x = 12 sont données dans le tableau 28.14.
|
π |
β |
Puissance |
|
0,30 |
0,9155 |
0,0845 |
|
0,35 |
0,7802 |
0,2198 |
|
0,40 |
0,5785 |
0,4215 |
|
0,45 |
0,3592 |
0,6408 |
|
0,50 |
0,1808 |
0,8192 |
|
0,55 |
0,0714 |
0,9286 |
Dans ce cas, nos données ne permettent pas de déterminer si π est plus grand que la valeur nulle de 0,25 mais inférieur à 0,50, car la puissance de l’étude est trop faible (<80%) aux valeurs de π <0,5. Autrement dit, la sensibilité de notre étude est de 8% pour π = 0,3, 22% pour π = 0,35, ... et 64% pour π = 0,45.
Le seul moyen de réduire la valeur de β ou d’accroître la puissance serait d’augmenter la taille de l’étude. Par exemple, le tableau 28.15 présente les valeurs de β et de la puissance pour n = 40; comme prévu, nous devrions trouver une valeur de π supérieure à 0,40.
|
π |
β |
Puissance |
|
0,30 |
0,5772 |
0,4228 |
|
0,35 |
0,3143 |
0,6857 |
|
0,40 |
0,1285 |
0,8715 |
|
0,45 |
0,0386 |
0,8614 |
|
0,50 |
0,0083 |
0,9917 |
|
0,55 |
0,0012 |
0,9988 |
La conception du plan d’étude se fonde sur un examen minutieux de la série d’hypothèses alternatives qui méritent d’être prises en considération et garantissent une puissance adéquate à l’étude, pourvu que la taille de l’échantillon soit suffisante.
La littérature épidémiologique souligne combien il est important de fournir des estimations de risque sûres. Par conséquent, il vaut beaucoup mieux donner l’intervalle de confiance (à 95% ou à 90%) qu’une valeur de p pour un test d’hypothèse. Le même type de raisonnement impose de porter une attention particulière à l’interprétation des résultats tirés de petits échantillons: par suite d’une faible puissance, même des effets intermédiaires pourraient passer inaperçus et des effets de grande amplitude pourraient ne pas se reproduire ultérieurement.
Le degré de complexité des méthodes statistiques utilisées en médecine du travail n’a cessé d’augmenter ces dernières années. C’est dans le domaine des modèles statistiques que se sont produits les progrès les plus remarquables. La famille des modèles non gaussiens de Wedderburn et Nelder (modèles linéaires généralisés) a contribué d’une façon marquante à l’augmentation de nos connaissances dans des domaines tels que l’épidémiologie du travail, où les variables d’effet sont binaires (par exemple, survie/mort) ou numériques (par exemple, nombre d’accidents du travail dans l’industrie).
Ces progrès ont constitué le point de départ d’une substitution généralisée des modèles de régression aux méthodes d’analyse traditionnelles basées sur les tableaux de contingence (analyses simples ou stratifiées). La régression de Poisson ou de Cox et la régression logistique servent maintenant couramment à l’analyse des études longitudinales ou des études cas-témoins. Ces modèles, qui sont l’équivalent de la régression linéaire pour des variables nominales d’effet, ont l’avantage de donner directement la mesure épidémiologique pertinente d’association. Par exemple, les coefficients de régression de Poisson sont le logarithme des risques relatifs, tandis que ceux de la régression logistique sont le logarithme des rapports des cotes ou odds ratios.
A partir de là, les développements de la modélisation statistique ont pris deux principales orientations: les modèles pour les mesures nominales répétées et ceux qui étendent les modèles linéaires généralisés (modèles additifs généralisés). Dans les deux cas, l’objectif est d’accroître la souplesse des outils statistiques afin d’aborder des problèmes plus complexes reflétant la réalité. Des modèles de mesures répétées sont nécessaires dans de nombreuses études d’épidémiologie du travail qui s’intéressent à des unités d’analyse infra-individuelles. Par exemple:
Des progrès parallèles, probablement plus rapides, ont été enregistrés dans le contexte de la statistique bayésienne. L’obstacle pratique à l’utilisation des méthodes bayésiennes a disparu avec l’introduction des méthodes informatisées. Les schémas d’échantillonnage de Gibbs, fondés sur la méthode de Monte Carlo, nous ont permis d’éviter l’intégration numérique nécessaire pour calculer les probabilités a posteriori, qui représentaient la caractéristique la plus redoutable des méthodes bayésiennes. Les applications des modèles bayésiens de problèmes réels et complexes occupent de plus en plus d’espace dans les revues spécialisées. Ainsi, les analyses géographiques et les corrélations écologiques à très grande échelle de même que les modèles de prédiction du sida font de plus en plus souvent appel aux approches bayésiennes. Ces développements sont certes bénéfiques non seulement parce qu’ils renforcent l’arsenal statistique servant à l’analyse des données épidémiologiques, mais aussi parce que l’approche bayésienne est probablement la plus solide.
Les articles précédents ont démontré la nécessité d’une évaluation rigoureuse du plan d’étude pour aboutir à des conclusions crédibles à partir d’observations épidémiologiques. Même si l’on dit couramment que les déductions fondées sur l’épidémiologie d’observation sont peu fiables du fait de la nature non expérimentale de cette discipline, les essais randomisés contrôlés ou n’importe quel autre plan d’étude ne sont pas intrinsèquement supérieurs à des modèles observationnels bien planifiés (Cornfield, 1954). Toutefois, pour tirer des conclusions solides, il est nécessaire de faire une analyse approfondie du plan d’étude afin d’y déceler les sources potentielles de biais et de confusion, qui peuvent donner lieu aussi bien à de faux positifs qu’à de faux négatifs.
Nous examinons, dans le présent article, quelques lignes directrices sur l’évaluation de la nature causale des observations épidémiologiques. Et, même si l’application de bons principes scientifiques garantit souvent une recherche épidémiologique responsable, il importe de penser à certains points complémentaires se rattachant à l’éthique épidémiologique. Nous avons donc consacré quelques paragraphes à l’analyse des problèmes moraux qui peuvent se poser au cours d’études épidémiologiques.
Différents auteurs ont abordé la question de l’évaluation des causes en épidémiologie (Hill, 1965; Buck, 1975; Ahlbom, 1984; Maclure, 1985; Miettinen, 1985; Rothman, 1986; Weed, 1986; Schlesselman, 1987; Maclure, 1988; Weed, 1988; Karhausen, 1995). L’une des principales questions qui se posent à cet égard est de savoir si l’épidémiologie utilise ou doit utiliser les mêmes critères que les autres disciplines scientifiques pour vérifier la causalité.
Il ne faut pas confondre les causes avec les mécanismes. Par exemple, l’amiante est une cause de mésothéliome alors que la mutation oncologique en est le mécanisme présumé. Sur la base des observations existantes, a) il est vraisemblable que les différentes expositions exogènes puissent déclencher les mêmes cascades de mécanismes; b) habituellement il n’y a pas d’ordre préétabli dans les différentes étapes mécanistes conduisant à la maladie. Ainsi la cancérogenèse est interprétée comme une succession de transitions stochastiques (probabilistes), partant d’une mutation génétique qui entraîne une prolifération cellulaire, elle-même génératrice de mutations génétiques pouvant aboutir au cancer. De plus, la cancérogenèse est un processus multifactoriel: en fait, différentes expositions exogènes sont susceptibles d’affecter le processus, mais aucune n’est nécessaire chez une personne prédisposée. Il est possible que ce modèle s’applique à diverses pathologies à part le cancer.
La nature multifactorielle et probabiliste de la plupart des relations exposition-maladie implique qu’il est difficile d’établir avec précision le rôle joué par une exposition spécifique. De plus, la nature observationnelle de l’épidémiologie empêche de mener des expériences pouvant mettre les causes en lumière en altérant délibérément le fil des événements. L’observation d’une association statistique entre l’exposition et la maladie ne signifie pas que l’association soit causale. Ainsi, la majorité des épidémiologistes ont jugé que l’association entre l’exposition aux fumées de carburant diesel et le cancer de la vessie avait un caractère causal, mais d’autres ont fait remarquer que les travailleurs exposés à ces fumées (surtout des camionneurs et des chauffeurs de taxi) étaient plus souvent des fumeurs que les sujets non exposés. L’association observée serait ainsi «confondue» avec le facteur de risque bien connu qu’est le tabac.
Etant donné la nature probabiliste et multifactorielle de la plupart des associations exposition-maladie, les épidémiologistes ont établi des lignes directrices pouvant aider à reconnaître les relations vraisemblablement causales. Voici les critères initialement proposés par sir Bradford Hill (1965) dans le cas des maladies chroniques:
Ces critères ne doivent être considérés que comme des recommandations générales ou des outils pratiques; en fait, l’évaluation scientifique de la causalité est un processus itératif centré sur la mesure de la relation exposition-maladie. Toutefois, les critères de Hill servent souvent de moyen précis et pratique de description des relations causales en épidémiologie.
Essayons par exemple d’appliquer les critères de Hill à la relation entre l’exposition au chlorure de vinyle et l’angiosarcome hépatique.
La façon habituelle d’exprimer les résultats d’une étude épidémiologique est de donner une mesure du degré d’association entre l’exposition et la maladie (premier critère de Hill). Un risque relatif (RR) supérieur à l’unité signifie qu’il existe une association statistiquement significative. Par exemple, si le taux d’incidence de l’angiosarcome hépatique, qui est habituellement de 1 pour 10 millions, est de 1 pour 100 000 parmi les personnes exposées au chlorure de vinyle, alors le RR est de 100, ce qui signifie que les travailleurs exposés à ce produit ont 100 fois plus de chances de développer un angiosarcome que la population non exposée.
Une relation est plus vraisemblablement causale quand le risque augmente avec le degré d’exposition (c’est l’effet dose-réponse, qui constitue le deuxième critère de Hill) et quand la relation temporelle entre l’exposition et la maladie semble logique compte tenu des données biologiques (l’exposition précède l’effet et la durée de la période d’«induction» est compatible avec un modèle biologique de la maladie, c’est le troisième critère de Hill). En outre, une association est plus susceptible d’être causale quand des résultats similaires ont été obtenus par d’autres chercheurs qui ont reproduit les mêmes expériences dans des circonstances différentes (c’est la cohérence des conclusions, quatrième critère de Hill).
Une analyse scientifique des résultats nécessite une évaluation de la plausibilité biologique (cinquième critère de Hill). Cette dernière peut être évaluée de différentes manières. On peut ainsi déterminer si la «cause» soupçonnée a une voie d’accès à l’organe cible (par exemple, les substances inhalées qui n’atteignent pas les poumons ne peuvent pas circuler dans l’organisme). De même, des preuves obtenues à partir d’études animales sont utiles: l’observation d’angiosarcomes hépatiques chez des animaux traités au chlorure de vinyle renforce l’idée d’une association chez l’humain.
La cohérence interne des observations (le fait, par exemple, que le risque relatif augmente dans la même proportion chez les hommes et les femmes) est un important critère scientifique (sixième critère de Hill). La causalité est plus vraisemblable quand la relation est très spécifique, c’est-à-dire quand les causes ou les maladies sont rares ou ne touchent qu’un type ou sous-groupe histologique particulier de patients (septième critère de Hill).
L’«induction énumérative» (c’est-à-dire la simple énumération d’exemples d’associations exposition-maladie) ne suffit pas pour décrire complètement les étapes inductives dans le raisonnement causal. La plupart du temps, l’induction énumérative produit une observation complexe et confuse où sont imbriquées plusieurs chaînes causales ou encore une authentique relation causale et d’autres expositions sans rapport avec elle. Les explications «alternatives» doivent être éliminées par «induction discriminante», de façon à démontrer qu’une association causale est plausible parce qu’elle n’est pas «confondue» avec d’autres. Une définition simple de l’explication alternative serait la suivante: «facteur étranger dont l’effet est mêlé à celui de l’exposition considérée, déformant l’estimation du risque lié à cette dernière» (Rothman, 1986).
Le rôle de l’induction est d’étendre la connaissance, tandis que celui de la déduction est de «transmettre la vérité» (Giere, 1979). Le raisonnement déductif permet d’examiner minutieusement le plan d’étude et de reconnaître toutes les associations logiquement sinon empiriquement vraies. De telles relations sont non pas des questions de fait, mais des nécessités logiques. Par exemple, un biais de sélection se produit quand le groupe exposé est choisi parmi la population malade (ce serait le cas si, pour lancer une étude de cohorte, on recrutait comme groupe d’«exposés» au chlorure de vinyle une série de cas d’angiosarcome hépatique) ou quand le groupe non exposé est choisi parmi la population bien portante. Dans les deux cas, l’association constatée entre exposition et maladie est nécessairement (logiquement) mais non empiriquement vraie (Vineis, 1991).
Pour conclure, disons que même si elle est par nature observationnelle (non expérimentale), l’épidémiologie n’utilise pas des méthodes déductives fondamentalement différentes de celles qu’emploient d’autres disciplines scientifiques (Hume, 1978; Schaffner, 1993).
Du fait des subtilités impliquées dans la recherche de la causalité, les épidémiologistes doivent apporter un soin particulier à l’interprétation des résultats de leurs études. En effet, plusieurs considérations éthiques en dépendent.
Les problèmes éthiques sont devenus un sujet d’âpres discussions en recherche épidémiologique (Schulte, 1989; Soskolne, 1993; Beauchamp et coll., 1991). La raison en est évidente: les épidémiologistes, en particulier ceux de la médecine du travail et de l’hygiène du milieu, étudient souvent des problèmes ayant des répercussions économiques, sociales et sur la santé publique. Les résultats négatifs et positifs ayant trait à l’association entre l’exposition à des produits chimiques spécifiques et la maladie peuvent affecter la vie de milliers de travailleurs, influencer des décisions économiques et, partant, des choix politiques. Concrètement parlant, l’épidémiologiste peut, sous la pression, être porté, voire encouragé à modifier — marginalement ou profondément — l’interprétation des résultats de ses travaux de recherche.
Parmi les nombreux problèmes éthiques intéressant la recherche épidémiologique, la transparence dans la collecte, le codage, l’enregistrement et l’analyse des données est un élément essentiel pour se prémunir contre les allégations de biais. Le droit qu’ont les personnes retenues d’être préservées de la diffusion des informations personnelles (confidentialité des données) est tout aussi important, surtout qu’il risque d’entrer en conflit avec la transparence souhaitée.
Pour se prémunir contre d’éventuelles accusations, en particulier lors de la recherche d’inductions causales, il importe que les lignes directrices traitant des considérations éthiques tiennent compte des questions suivantes:
D’autres problèmes très délicats se posent en épidémiologie du travail et du milieu: faut-il associer les travailleurs aux phases préliminaires des études et en divulguer les résultats aux sujets retenus et directement affectés (Schulte, 1989)? Malheureusement, il n’est pas courant de faire participer les travailleurs recrutés pour une étude épidémiologique à la discussion des objectifs de l’étude, à l’interprétation des résultats et à leurs applications possibles (qui peuvent tout aussi bien servir les travailleurs que leur nuire).
Certaines recommandations ont apporté une réponse partielle à ces questions (Beauchamp et coll., 1991; CIOMS, 1991). Cependant, dans chaque pays, les associations professionnelles d’épidémiologistes du travail devraient engager des discussions approfondies sur les problèmes éthiques afin d’adopter dans la mesure du possible des lignes directrices qui soient adaptées au contexte local tout en respectant les normes internationales.
Dans un pays comme Taiwan (Chine), la recherche sur les maladies professionnelles est un défi pour le médecin du travail. Du fait de l’absence d’un système fondé sur les fiches de données de sécurité sur les produits (FDS), les travailleurs n’étaient en général pas au courant de la nature de ceux qu’ils manipulaient. Comme de nombreuses maladies professionnelles se développent lentement sans signes ni symptômes spécifiques jusqu’à l’apparition clinique, l’identification et la reconnaissance de leur origine professionnelle sont souvent très difficiles.
Pour une meilleure prise en charge de ces pathologies, nous avons effectué des recherches dans des bases de données contenant une liste relativement complète des produits chimiques industriels, ainsi que des signes ou symptômes spécifiques qui leur sont associés. En reliant cette information à une démarche épidémiologique de type conjecture-réfutation (dans laquelle on envisage puis rejette toutes les explications possibles), nous avons pu documenter plus de dix maladies professionnelles et un cas de botulisme. Nous recommandons la mise en œuvre de ce type d’approche dans tout pays dont la situation est similaire, avec établissement d’un système de fiches de données de sécurité pour chaque produit chimique manipulé, pour diagnostiquer rapidement les maladies à caractère professionnel et en assurer la prévention.
Trois ouvriers d’un atelier d’impression en couleurs ont été hospitalisés en 1985. Ils présentaient des signes d’hépatite aiguë, associés chez l’un d’eux à une insuffisance rénale aiguë elle aussi. Etant donné que l’hépatite virale a un taux de prévalence élevé à Taiwan (Chine), nous avions considéré l’hépatite virale comme l’une des causes les plus plausibles. Les autres causes envisagées comprenaient l’alcool, la drogue et l’exposition à des solvants organiques sur les lieux de travail. Comme il n’existait alors aucun système de FDS à Taiwan (Chine), ni les travailleurs ni l’employeur ne connaissaient la liste des produits chimiques utilisés dans l’atelier (Wang, 1991).
Il nous a donc fallu établir une liste d’agents hépatotoxiques et néphrotoxiques à partir de plusieurs bases de données toxicologiques. Nous avons ensuite examiné toutes les explications possibles à partir des hypothèses précédentes. Ainsi, dans l’hypothèse du virus de l’hépatite A (VHA), on aurait dû observer des anticorps (VHA-IgM) chez les travailleurs affectés; si le virus de l’hépatite B avait été en cause, nous aurions dû trouver plus d’antigènes de surface de l’hépatite B (HBsAg) chez les sujets atteints que chez les autres; si l’alcool constituait le facteur étiologique principal des signes d’hépatite, nous aurions dû observer davantage de buveurs ou d’alcooliques chroniques parmi les travailleurs malades; si enfin la pathologie était imputable à un solvant toxique (comme le chloroforme), nous aurions dû en trouver la trace sur les lieux de travail.
Nous avons procédé à une évaluation clinique approfondie de chaque malade. L’étiologie virale a été facilement rejetée, ainsi que l’hypothèse d’alcoolisme, les faits ne les confirmant pas.
Par contre, 17 des 25 travailleurs de l’atelier avaient des tests de fonction hépatique anormaux, et une association significative a été mise en évidence entre les troubles hépatiques et des affectations récentes dans l’une des trois pièces où un système de climatisation avait été installé pour refroidir les presses. Cette association a persisté après stratification des sujets selon le critère de porteur de l’hépatite B. Il a été établi plus tard que l’incident découlait de l’utilisation accidentelle d’un «dégraissant» (en l’occurrence du tétrachlorure de carbone) pour nettoyer la pompe de l’une des presses. En outre, une simulation de l’opération de nettoyage a révélé la présence de concentrations ambiantes de ce produit comprises entre 115 et 495 ppm, concentrations qui peuvent provoquer des lésions hépatiques. Un essai de réfutation, consistant à retirer le tétrachlorure de carbone des lieux de travail, a permis de constater qu’aucun nouveau cas n’était signalé parmi les travailleurs; de plus, l’état de santé de tous les sujets touchés s’est rapidement amélioré après une absence de vingt jours des lieux de travail. Nous avons ainsi pu conclure que les symptômes étaient dus à l’utilisation du tétrachlorure de carbone.
En septembre 1986, un apprenti dans un atelier d’impression en couleurs de Chang-Hwa a brutalement développé une faiblesse aiguë bilatérale et une paralysie respiratoire. Au téléphone, le père de la victime a affirmé que plusieurs autres travailleurs de l’atelier présentaient les mêmes symptômes. Comme on avait déjà signalé, dans des ateliers d’impression en couleurs, des maladies professionnelles liées à l’exposition à des solvants organiques, nous nous sommes rendus sur les lieux pour déterminer la cause des signes cliniques, pensant que nous aurions affaire à une intoxication aux solvants (Wang, 1991).
Nous avions pour principe d’envisager toutes les explications possibles, y compris d’autres problèmes médicaux provoquant l’altération fonctionnelle des neurones moteurs supérieurs et inférieurs ou de la jonction neuromusculaire. Une fois de plus, nous avons considéré les effets de chacune des hypothèses envisagées. Par exemple, une exposition à un solvant susceptible d’entraîner des polyneuropathies (comme le n-hexane, le méthylbutylcétone ou l’acrylamide) aurait dû perturber la vitesse de conduction nerveuse (VCN). S’il s’agissait d’autres problèmes médicaux liés aux motoneurones supérieurs, on devait également relever des signes de perturbations de la conscience ou des mouvements involontaires.
Les observations sur le terrain ont révélé que tous les travailleurs affectés étaient restés lucides. L’étude de la VCN chez trois des patients n’a mis en évidence aucun trouble des motoneurones inférieurs. Ils n’avaient pas d’antécédents de mouvements involontaires, de prise de médicaments, de morsures ou de piqûres avant l’apparition des symptômes. Le test à la néostigmine était négatif. Toutefois, les observations ont mis en évidence une association significative entre la maladie et le fait d’avoir pris le petit déjeuner à la cafétéria de l’atelier le 26 ou le 27 septembre: 7 sur 7 des travailleurs contaminés contre 7 sur les 32 asymptomatiques avaient pris le petit déjeuner à l’atelier au cours de ces deux jours. Un test ultérieur a confirmé la présence de la toxine du botulisme de type A dans des boîtes de conserve d’arachides venant d’une usine non agréée. Des cultures faites sur les échantillons ont également révélé la prolifération de Clostridium botulinum. L’essai final de réfutation a consisté à retirer du marché ces produits avariés et à constater l’absence de nouveaux cas. Cette recherche a permis de documenter les premiers cas de botulisme dus à des conserves alimentaires commerciales produites à Taiwan (Chine).
En juin 1983, deux travailleurs d’une usine de paraquat sont venus consulter dans une clinique de dermatologie en se plaignant de nombreuses macules bilatérales hyperpigmentées, avec des plages hyperkératotiques sur des parties des mains, du cou et du visage exposées au soleil. Certains autres endroits du corps présentaient des transformations évoquant la maladie de Bowen. Comme des lésions cancéreuses et précancéreuses de la peau avaient été signalées parmi les travailleurs s’occupant de la fabrication du bipyridyle, nous avons immédiatement envisagé une origine professionnelle. Toutefois, nous devions également considérer d’autres étiologies ou hypothèses possibles: exposition à des rayonnements ionisants ou contact avec du goudron, du brai ou d’autres hydrocarbures polyaromatiques. Pour examiner toutes ces hypothèses, nous avons entrepris une étude en 1985, dans le cadre de laquelle nous avons visité l’ensemble des vingt-huit sites présents ou passés de fabrication ou d’emballage du paraquat et avons procédé à un contrôle des méthodes de fabrication et à un examen des travailleurs (Wang et coll., 1987; Wang, 1993).
Nous avons examiné 228 travailleurs. Aucun d’entre eux n’avait jamais été en contact avec les substances cancérogènes susmentionnées sauf les rayons solaires, la 4’-4’-bipyridine et ses isomères. Après avoir exclu les travailleurs soumis à de multiples expositions, nous avons noté que 1 des 7 cadres et 2 des 82 ouvriers employés à l’emballage du paraquat avaient développé des lésions hyperpigmentées de la peau, comparativement à 3 des 3 travailleurs affectés à la cristallisation et à la centrifugation de la bipyridine. De plus, les 17 travailleurs qui présentaient des hyperkératoses ou des lésions de Bowen avaient tous des antécédents d’exposition directe au bipyridyle et à ses isomères. Plus l’exposition à ces produits était longue, plus les travailleurs étaient susceptibles de présenter des lésions cutanées. Cette tendance ne pouvait pas être expliquée par l’exposition au soleil ou par l’âge, comme l’ont démontré la stratification et l’analyse par régression logistique. De ce fait, les lésions cutanées ont été provisoirement attribuées à une double exposition au bipyridyle et aux rayons solaires. Nous avons procédé plus tard à des essais de réfutation en vérifiant si de nouveaux cas avaient été signalés après l’encoffrement de tous les processus de fabrication susceptibles d’occasionner une exposition au bipyridyle. Aucun nouveau cas n’était survenu.
Les trois exemples précédents montrent l’importance de l’approche de réfutation et d’une base de données sur les maladies professionnelles. La première impose d’envisager les hypothèses alternatives au même titre que les hypothèses intuitives initiales, tandis que la seconde procure une liste détaillée d’agents chimiques susceptible de mettre en évidence la véritable étiologie. L’une des limites de cette démarche tient au fait qu’on ne peut considérer que les hypothèses auxquelles on a pu penser. Si notre liste d’hypothèses est incomplète, on peut fort bien se trouver sans réponse, voire obtenir une réponse erronée. Aussi est-il indispensable pour le succès de cette stratégie de disposer d’une base de données fiable sur les maladies professionnelles.
Dans le passé, nous avions laborieusement tenté de construire notre propre base de données. Toutefois, les bases OSH-ROM, qui contiennent la base NIOSHTIC dans laquelle figurent plus de 160 000 résumés, constituent probablement la source d’information la plus complète dans ce domaine. Pour de plus amples renseignements sur cette question, on pourra se reporter au chapitre «L’information et la sécurité au travail» de la présente Encyclopédie. En outre, si une nouvelle maladie professionnelle survenait, nous pourrions effectuer une recherche dans une de ces bases et écarter tous les agents étiologiques connus susceptibles de causer la maladie, n’en laissant aucun sans le réfuter. Dans une telle situation, nous pourrions essayer d’identifier et de définir le nouvel agent causal (ou la profession impliquée) de façon aussi précise que possible, d’abord pour remédier au problème, ensuite pour tester de nouvelles hypothèses. Le cas des lésions précancéreuses de la peau chez les travailleurs du paraquat illustre bien le propos.
La recherche épidémiologique sert en général à répondre à une question précise visant à établir un lien entre l’exposition d’individus à des substances ou à des situations dangereuses et des effets ultérieurs sur la santé, comme le cancer ou la mort. Toutes les enquêtes — ou presque — sont effectuées grâce à un questionnaire qui constitue l’outil de base de collecte des données. Même quand il faut procéder à des mesures physiques en milieu de travail, et surtout si l’on doit prélever des matières biologiques, comme du sérum, sur des sujets exposés ou non, il est essentiel de disposer d’un questionnaire pour se faire une idée précise de l’exposition en recueillant systématiquement des données sur différentes caractéristiques personnelles ou non des sujets, d’une manière organisée et cohérente.
Le questionnaire remplit plusieurs fonctions déterminantes pour la recherche:
Même si le questionnaire constitue souvent la partie la plus visible d’une étude épidémiologique, particulièrement pour les travailleurs et les autres participants, il n’est pour le chercheur qu’un outil, ou plus précisément un «instrument». La figure 28.1 décrit d’une façon très générale les étapes d’une étude, depuis la conception jusqu’à l’analyse, en passant par la collecte des données. On y voit quatre niveaux ou paliers opératoires qui se déroulent en parallèle tout au long de l’étude: échantillonnage; questionnaire; opérations et analyse. La figure montre très clairement la façon dont les étapes de développement du questionnaire sont reliées au plan général de l’étude, partant de l’idée initiale de la première version du questionnaire et des codes correspondants, passant ensuite au prétest dans une sous-population choisie, puis à une ou plusieurs révisions découlant de l’expérience acquise durant le prétest, pour aboutir à la préparation du document final devant servir à la collecte effective des données sur le terrain. Le plus important est le contexte: chaque étape du développement du questionnaire est menée parallèlement à une étape correspondante de création et de perfectionnement du plan global d’échantillonnage, ainsi que du protocole opérationnel d’administration du questionnaire.
Les objectifs de recherche de l’étude déterminent la structure, la longueur et le contenu du questionnaire. Ces attributs sont invariablement modulés par la méthode de collecte des données, qui se fait en général de l’une des trois manières suivantes: par contact personnel, par courrier et par téléphone. Chacune a ses avantages et ses inconvénients, qui peuvent influer non seulement sur la qualité des données, mais aussi sur la validité de toute l’étude.
Le questionnaire postal est le moins coûteux. Il peut couvrir les travailleurs d’une vaste aire géographique. Toutefois, le taux de réponse est souvent faible (habituellement, 45 à 75%), le questionnaire ne peut pas être trop complexe puisqu’il n’est guère possible — quand il n’est pas impossible — de fournir des éclaircissements sur les questions. Il peut aussi être difficile de vérifier si les réponses potentielles au sujet d’une exposition critique ou d’autres questions diffèrent systématiquement entre les répondants et les non-répondants. La mise en page et le vocabulaire doivent être adaptés aux moins instruits des participants et il doit être possible de répondre à toutes les questions dans un laps de temps assez court, de l’ordre de vingt à trente minutes.
Les questionnaires téléphoniques peuvent être utilisés dans les études de population, c’est-à-dire dans les enquêtes portant sur un échantillon d’une population géographiquement définie. Ils constituent également un moyen commode de mise à jour de fichiers de données existants. Ils peuvent être plus longs et plus complexes que les questionnaires postaux et comme ils sont administrés par des enquêteurs ayant reçu une formation spéciale, on peut partiellement compenser le coût plus élevé de l’enquête téléphonique en structurant le questionnaire de façon à en faciliter l’administration (grâce, par exemple, à des instructions de branchement du genre «si oui, passez à...»). Les taux de réponse sont souvent meilleurs que dans le cas des questionnaires postaux, mais sont sujets à des biais liés à l’utilisation croissante des répondeurs téléphoniques, aux refus, à l’impossibilité de joindre le sujet et au problème des populations ayant un accès limité au service téléphonique. De tels biais sont généralement reliés au plan d’échantillonnage lui-même et pas nécessairement au questionnaire. Bien que les questionnaires téléphoniques soient depuis longtemps d’un usage courant en Amérique du Nord, leur faisabilité dans d’autres régions du monde reste encore à démontrer.
Les entrevues directes constituent le meilleur moyen de recueillir des données complexes d’une manière précise; elles sont aussi les plus coûteuses à réaliser, car elles nécessitent de former une équipe professionnelle et de payer ses frais de déplacement. La présentation et l’ordre des questions peuvent être organisés de façon à optimiser le temps d’entretien. Les études basées sur des entrevues directes ont généralement les taux de réponse les plus élevés et le minimum de biais de réponse. Il s’agit également du type d’étude où l’enquêteur est le plus susceptible d’apprendre si le participant est un cas ou non (dans une étude cas-témoins) ou d’évaluer son statut d’exposition (dans une étude de cohorte). Il faut donc prendre soin de préserver l’objectivité de l’enquêteur en lui apprenant à éviter les questions orientées et les attitudes qui pourraient induire des réponses biaisées.
Il est de plus en plus courant d’utiliser un protocole d’étude hybride dans lequel les situations complexes d’exposition sont évaluées au cours d’une entrevue directe ou téléphonique qui permet d’obtenir un maximum de renseignements et d’éclaircissements, suivie d’un questionnaire postal destiné à recueillir des données sur le mode de vie, comme le tabagisme ou les habitudes alimentaires.
L’objectif d’un questionnaire étant d’obtenir des données sur des individus, sa conception doit respecter les normes d’éthique établies pour le traitement des êtres humains. Ces normes s’appliquent aussi bien à l’acquisition des données à inscrire sur le questionnaire qu’aux prélèvements de sang ou d’urine ou aux tests génétiques. Aux Etats-Unis et dans beaucoup d’autres pays, aucune étude portant sur des êtres humains et bénéficiant d’un financement public ne peut être menée sans qu’un «comité institutionnel d’examen» n’ait approuvé le contenu du questionnaire et le libellé des questions. Cette approbation n’est donnée que si les questions se limitent aux besoins légitimes de l’étude et respectent les droits des participants. Ceux-ci doivent être assurés que leur participation est entièrement facultative et que leur refus de répondre à des questions ou même de participer à l’enquête n’entraînera aucune sanction et ne modifiera en rien leurs relations avec leur employeur ou leur médecin traitant.
Les participants doivent également être assurés que l’information qu’ils donnent restera strictement confidentielle et que les responsables prendront toutes les précautions nécessaires pour garantir la sécurité matérielle et l’inviolabilité des données. Il arrive souvent que, à cette fin, on scinde les données elles-mêmes de l’identité des participants dans les fichiers informatiques. Il est également courant d’aviser les participants que leurs réponses ne seront utilisées dans des rapports statistiques qu’après avoir été regroupées avec celles d’autres participants et qu’elles ne seront pas dévoilées à l’employeur, aux médecins ou à d’autres parties.
Une des plus importantes fonctions d’un questionnaire est d’obtenir des données qualitatives ou quantitatives sur des caractéristiques ou des aspects précis d’un individu. Certaines questions peuvent simplement porter sur le poids, la taille ou l’âge, alors que d’autres peuvent être considérablement plus complexes, comme la réaction individuelle au stress. Les réponses qualitatives, comme le sexe, sont en général converties en variables numériques. Toutes les mesures de ce type se caractérisent par leur validité et leur précision. La validité est la mesure dans laquelle un nombre dérivé du questionnaire est proche de la vraie valeur, qui est souvent inconnue. La précision concerne la probabilité qu’une mesure donne le même résultat lorsqu’elle est répétée, que ce résultat soit proche ou non de la valeur «réelle». La figure 28.2 illustre les liens qui existent entre ces concepts. Elle montre qu’une mesure peut être valide mais non pas précise, précise mais non pas valide ou valide et précise.
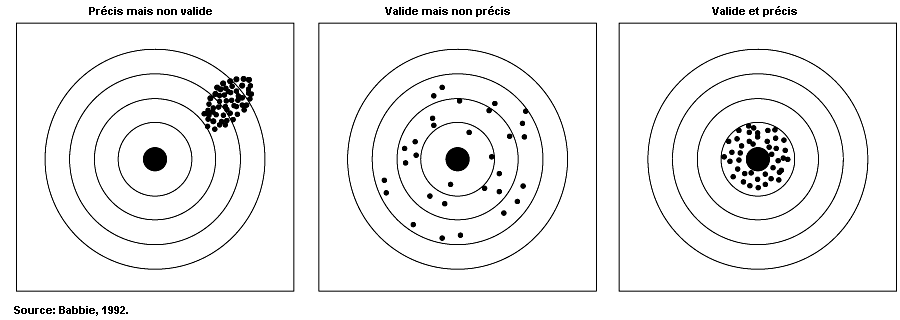
Au fil des ans, de nombreux questionnaires ont été développés par les chercheurs pour répondre à des questions très diverses. Entre autres exemples, il y a lieu de mentionner le Scholastic Aptitude Test (test d’aptitude scolaire) qui évalue le potentiel de réussite à l’université, et le Minnesota Multiphasic Personality Inventory (l’inventaire multiphasique de la personnalité du Minnesota) qui mesure certains traits psychosociaux. De très nombreux autres indicateurs psychologiques sont examinés dans le chapitre «Les facteurs psychosociaux et organisationnels». Il existe également des échelles physiologiques éprouvées, comme le questionnaire du Conseil britannique de la recherche médicale (British Medical Research Council (BMRC)) sur la fonction pulmonaire. Ces instruments présentent plusieurs grands avantages, le principal étant qu’ils ont déjà été mis au point et testés, généralement dans plusieurs populations, et que leur précision et leur validité sont connues. Toute personne élaborant un questionnaire serait bien avisée d’utiliser ces échelles si elles conviennent à l’objectif de l’étude. Ainsi, elle évitera de «réinventer la roue», mais elle aura surtout pous de chances que les résultats de l’étude soient acceptés et reconnus par la communauté scientifique. Par ailleurs, une utilisation correcte de ces échelles facilite la comparaison des résultats obtenus dans des études différentes.
Les échelles précédentes sont des exemples de deux types importants de mesures, couramment utilisées dans les questionnaires pour quantifier des concepts qui peuvent ne pas être objectivement mesurables au sens où le sont la taille ou le poids, ou qui requièrent plusieurs questions similaires pour couvrir entièrement le domaine d’un modèle comportemental donné. Plus généralement, les indices et les échelles sont deux techniques de réduction des données qui présentent un résumé chiffré de groupes de questions. Les exemples donnés plus haut illustrent des indices physiologiques et psychologiques fréquemment utilisés pour mesurer le niveau de connaissance, l’attitude et le comportement. Brièvement, un indice est habituellement construit comme un score obtenu en comptant dans un groupe de questions le nombre de rubriques qui s’appliquent au participant. Par exemple, si un questionnaire présente une liste de maladies, un indice de l’historique de maladie pourrait être le nombre total de maladies qu’un répondant dit avoir contractées. Une échelle est une mesure composite basée sur l’intensité avec laquelle un participant répond à une ou plusieurs questions. Ainsi, l’échelle de Likert, fréquemment employée en recherche sociologique, est typiquement conçue avec des affirmations au sujet desquelles le répondant se dit tout à fait d’accord, modérément d’accord, sans opinion, pas d’accord ou tout à fait opposé, les réponses étant cotées de 1 à 5. Les échelles et les indices peuvent s’additionner ou se combiner différemment pour composer une image assez complète des caractéristiques physiques, psychologiques, sociales ou comportementales des participants.
La validité mérite une attention particulière, car elle est le reflet de la «vérité». Il existe trois principaux types de validité: la validité apparente; la validité de contenu; et la validité prédictive. La validité apparente est une qualité subjective d’un indicateur qui assure que le libellé d’une question est clair et sans ambiguïté. La validité de contenu permet d’assurer que les questions couvrent bien la dimension de la réponse qui intéresse le chercheur. La validité prédictive est dérivée d’une mesure objective de l’écart entre l’évaluation d’une quantité par le questionnaire et par une méthode indépendante: par exemple, à quel point l’évaluation par questionnaire de l’apport en vitamine A correspond à la quantité réelle de vitamine A absorbée d’après des relevés diététiques détaillés.
Libellé. La rédaction des questions est à la fois un art et une compétence professionnelle. Nous ne présenterons donc ici que des recommandations très générales à ce sujet. On admet en principe qu’il est souhaitable de concevoir des questions susceptibles:
Enchaînement et structure des questions. L’ordre et la présentation des questions peuvent influer sur la qualité de l’information recueillie. Un questionnaire typique, qu’il soit directement rempli par le sujet ou lu par l’enquêteur, contient un préambule qui introduit l’étude et son thème, donne toute information supplémentaire dont le sujet pourrait avoir besoin et cherche à inciter ce dernier à répondre. La plupart des questionnaires contiennent une partie destinée à recueillir des renseignements démographiques comme l’âge, le sexe, l’origine ethnique et d’autres variables y compris celles de nature confusionnelle. Le sujet principal du questionnaire, comme la nature du lieu de travail et l’exposition à des substances spécifiques, constitue souvent un volet à part, en général précédé de son propre préambule, qui peut rappeler au participant certains aspects particuliers du travail ou du lieu de travail afin de préparer le terrain à des questions détaillées. La présentation des questions qui visent à établir la chronologie du travail doit être conçue pour minimiser le risque d’omissions. Enfin, il est d’usage de terminer en remerciant l’enquêté pour sa participation.
Types de questions. L’auteur du questionnaire doit faire un choix entre des questions ouvertes auxquelles les participants donnent leurs propres réponses ou des questions fermées qui imposent des réponses définies ou un choix dans une courte liste de réponses possibles. Les questions fermées ont l’avantage de clarifier les choix pour l’enquêté, d’éviter les réponses elliptiques et de minimiser les longues digressions parfois impossibles à interpréter. Cependant, elles requièrent de l’auteur qu’il anticipe les réponses possibles afin d’éviter la perte d’information, particulièrement à l’égard des situations inattendues qui surviennent sur de nombreux lieux de travail. Cela nécessite un test pilote bien planifié. L’auteur doit en outre déterminer s’il peut accepter une réponse du type «je ne sais pas» et dans quelle mesure.
Longueur. Déterminer la longueur définitive d’un questionnaire exige un équilibre entre le désir d’obtenir le plus d’informations détaillées possibles pour aboutir aux objectifs de l’étude et le fait qu’un questionnaire trop long peut entraîner une perte d’intérêt de l’enquêté qui soit arrête de répondre, soit répond hâtivement, sans précision et sans réfléchir, dans le seul but d’arriver au plus vite à la fin. D’un autre côté, un questionnaire très court peut donner un taux de réponse élevé, sans toutefois atteindre les objectifs de l’étude. Puisque la motivation de l’enquêté dépend souvent de l’intérêt personnel qu’il porte aux résultats, comme l’amélioration des conditions de travail, la tolérance d’un long questionnaire peut beaucoup varier, surtout quand certains participants (comme les travailleurs d’une installation particulière) considèrent que leur intérêt personnel est supérieur à celui des autres (personnes contactées à l’aide d’un système d’appel aléatoire). On ne peut en général atteindre cet équilibre qu’en faisant des tests pilotes et en comptant sur l’expérience acquise. Il est souhaitable, dans le cas des entrevues directes, que l’enquêteur inscrive les heures du début et de la fin pour permettre d’en calculer la durée. Cette information est utile pour évaluer le niveau de qualité des données.
Vocabulaire. Il est essentiel d’utiliser le langage de la population cible afin de rendre le questionnaire compréhensible pour tous. Cela peut nécessiter de se familiariser avec le parler local qui peut varier d’une région à une autre. Même dans les pays où la même langue est véhiculaire, comme en Angleterre et aux Etats-Unis ou dans les pays hispaniques d’Amérique latine, les idiomes locaux et leur usage peuvent varier au point de fausser l’interprétation. Par exemple, aux Etats-Unis, «tea» désigne simplement une tasse de thé alors qu’en Angleterre, cela peut évoquer une théière pleine, une collation ou le repas principal du soir, selon le lieu et le contexte. Il est particulièrement important d’éviter le jargon scientifique, sauf si l’on sait que les participants ont des connaissances techniques particulières.
Clarté et questions orientées. Bien que les questions courtes soient souvent plus claires, il y a des exceptions, surtout lorsque le thème est complexe à présenter. Néanmoins, les questions courtes clarifient la pensée et réduisent les mots inutiles. Elles diminuent aussi le risque de surcharger l’enquêté d’informations difficiles à assimiler. Si le but de l’étude est d’obtenir une information objective sur la situation professionnelle du participant, il est important de rédiger les questions d’une façon neutre et d’éviter celles qui pourraient suggérer une réponse particulière, dans le style «êtes-vous d’accord pour dire que vos conditions de travail nuisent à votre santé?».
Présentation du questionnaire. La présentation matérielle du questionnaire peut influer sur le coût et l’efficacité d’une étude. Elle est plus importante quand le sujet doit lui-même remplir le questionnaire que lorsque c’est l’enquêteur qui le fait. Un autoquestionnaire trop complexe ou difficile à lire risque d’être rempli sans réfléchir ou simplement mis de côté. Même les questionnaires conçus pour être lus à haute voix par des enquêteurs expérimentés doivent être imprimés en caractères faciles à déchiffrer et porter des indications claires sur l’enchaînement des questions, de façon à réduire les changements de page et les recherches pour passer à la question suivante.
Le biais est l’ennemi d’une collecte objective de données. Il résulte de différences systématiques non planifiées entre des groupes de personnes: cas et témoins dans une étude cas-témoins ou exposés et non exposés dans une étude de cohorte. Le biais d’information peut se produire lorsque deux groupes de participants ne comprennent pas de la même façon une question ou y répondent différemment. C’est le cas, par exemple, quand les questions sont posées d’une telle manière qu’elles exigent une connaissance technique spéciale d’un lieu de travail ou de ses risques, connaissance que pourraient avoir des travailleurs exposés, mais pas nécessairement la population générale dans laquelle on a recruté les témoins.
Le recours à des sujets de substitution pour remplacer des travailleurs malades ou décédés comporte un risque de biais, car les proches parents sont susceptibles de restituer l’information différemment et avec moins de précision que le travailleur lui-même. La présence de ce biais est particulièrement vraisemblable dans les études où certaines entrevues sont faites directement avec les participants tandis que d’autres sont effectuées avec des parents ou des collègues d’autres participants. Dans les deux cas, il faut prendre soin de réduire l’effet de la connaissance par l’enquêteur du statut de maladie ou d’exposition du sujet. Comme il n’est pas toujours possible de cacher ces faits aux enquêteurs, il est important durant la formation de mettre l’accent sur l’objectivité et sur la nécessité d’éviter les questions orientées ou suggestives ou les gestes inconscients et d’assurer un contrôle de la performance tout au long de l’étude.
Le biais de remémoration se produit quand les cas et les témoins se «souviennent» différemment des expositions ou des situations de travail. Les cas hospitalisés pour une maladie susceptible d’être reliée à la profession sont plus à même de se rappeler les détails de leurs antécédents médicaux ou de leurs expositions professionnelles que des personnes contactées au hasard par téléphone. Une variante de ce type de biais, que l’on rencontre couramment depuis peu, pourrait s’appeler le biais de bienséance sociale: c’est la tendance qu’ont de nombreuses personnes à sous-estimer consciemment ou non leur penchant pour certaines mauvaises habitudes, comme le tabagisme ou la consommation d’aliments riches en gras et en cholestérol, et à surestimer les «bonnes habitudes» comme l’exercice physique.
Le biais de réponse dénote une situation dans laquelle un groupe de participants, tels les travailleurs subissant une exposition professionnelle particulière, peut être plus apte à remplir les questionnaires ou à participer à une étude que les personnes non exposées. Une telle situation peut entraîner une estimation biaisée de l’association exposition-maladie. On peut suspecter un biais de réponse si les taux de réponse ou les temps mis pour remplir le questionnaire ou répondre à l’enquêteur diffèrent significativement entre les groupes (cas par rapport à témoins, exposés par rapport à non exposés). Les biais de réponse varient généralement suivant le mode d’administration du questionnaire. Les questionnaires postaux sont souvent plus susceptibles d’être retournés par les personnes qui portent un intérêt personnel aux résultats de l’enquête et d’être oubliés ou jetés par les personnes choisies au hasard dans la population générale. De nombreux chercheurs qui utilisent les enquêtes postales élaborent un système de suivi pouvant comprendre un deuxième puis un troisième envoi, ainsi que des rappels téléphoniques, afin de maximiser les taux de réponse.
Les études qui emploient des enquêtes téléphoniques, y compris celles qui comportent un système d’appel aléatoire pour sélectionner les témoins, ont en général un protocole ou une série de règles établissant combien de tentatives doivent être faites pour joindre les sujets éventuels, à quel moment de la journée et si les appels en soirée et pendant la fin de semaine sont permis. Ceux qui mènent des études en milieu hospitalier notent habituellement le nombre de malades qui refusent de participer et leurs raisons. Dans tous ces cas, diverses mesures du taux de réponse sont enregistrées afin d’évaluer le degré de couverture de la population cible.
Le biais de sélection se produit quand un groupe de participants répond ou participe davantage que d’autres à une étude, ce qui entraîne une estimation biaisée de la relation entre exposition et maladie. Afin d’évaluer le biais de sélection et de distinguer s’il produit une sous-estimation ou une surestimation de l’exposition, on peut se servir de données démographiques telles que le niveau d’instruction pour comparer les répondants et les non-répondants. Par exemple, si les participants ayant un faible niveau d’instruction ont des taux de réponse plus bas que les participants plus instruits ou si l’on sait qu’un travail particulier ou certaines habitudes tabagiques sont plus fréquents chez les moins instruits, il est probable qu’il existe un biais de sélection avec sous-estimation de l’exposition pour le travail ou la catégorie de fumeurs en cause.
Les facteurs de confusion constituent un type important de biais de sélection qui se produit quand le choix des répondants (cas et témoins dans une étude cas-témoins, exposés et non-exposés dans une étude de cohorte) dépend d’une façon ou d’une autre d’une troisième variable, dont le chercheur n’est parfois pas conscient. Si cette variable n’est pas identifiée et contrôlée, elle peut mener de façon imprévisible à des sous-estimations ou à des surestimations des risques de maladie associés à des expositions professionnelles. On peut habituellement surmonter le problème de la confusion en modifiant le plan de l’étude (par exemple, en appariant les cas aux témoins en fonction de l’âge et d’autres variables) ou en intervenant au stade de l’analyse. Des détails de ces techniques sont présentés dans d’autres articles du présent chapitre.
Dans toute recherche, les procédures d’investigation doivent être minutieusement documentées pour que tous les membres de l’équipe, y compris les enquêteurs, les superviseurs et les chercheurs, soient au courant de leurs devoirs respectifs. Dans la plupart des études basées sur un questionnaire, un manuel de codage est préparé pour décrire question par question tout ce que l’enquêteur pourrait avoir besoin de connaître au-delà du strict libellé des questions. Le manuel comprend des instructions pour coder les réponses nominales et peut contenir des instructions explicites sur les explications et les questions supplémentaires que l’enquêteur peut utiliser pour faire préciser certaines réponses. Dans ce cas, le manuel peut énumérer les questions pour lesquelles l’enquêteur est autorisé à «sonder» l’enquêté et celles pour lesquelles il ne l’est pas. Dans de nombreuses études, des réponses nouvelles et imprévues à certaines questions sont occasionnellement rencontrées sur le terrain; elles doivent être enregistrées dans le manuel de codage et des copies des additifs, modifications ou nouvelles instructions doivent être distribuées à tous les enquêteurs en temps opportun.
Comme le montre la figure 28.1, la réalisation du questionnaire nécessite une planification approfondie. Il faut tester chaque questionnaire à plusieurs étapes afin d’être sûr que les questions «marchent», c’est-à-dire, qu’elles sont compréhensibles et produisent des réponses de la qualité attendue. Il est utile de tester les nouvelles questions sur des volontaires, puis de les interroger soigneusement pour déterminer s’il y a des problèmes ou des ambiguïtés. Les résultats peuvent alors servir pour réviser le questionnaire et l’opération peut être répétée si nécessaire. Les volontaires de ce genre constituent ce que l’on appelle souvent un «groupe de consultation».
Toutes les études épidémiologiques nécessitent un test pilote, non seulement pour les questionnaires, mais aussi pour les procédures. Un questionnaire bien conçu n’atteint son objectif que s’il peut être administré efficacement aux participants, ce que l’on ne peut vérifier qu’en réalisant des tests sur le terrain et en faisant les rajustements nécessaires.
L’enquêteur joue un rôle de premier plan dans les enquêtes par téléphone et par entrevue directe. Il est responsable non seulement de la présentation des questions aux participants et de l’enregistrement de leurs réponses, mais aussi de l’interprétation de ces dernières. Même dans le cadre d’une étude très rigidement structurée, il arrive à l’occasion que les enquêtés demandent des éclaircissements ou donnent des réponses qui ne correspondent pas aux catégories prévues. Dans ces cas, le travail de l’enquêteur est d’interpréter la question ou la réponse d’une manière qui concorde avec l’intention du chercheur. Pour que les enquêteurs puissent constamment travailler ainsi d’une manière efficace et uniforme, il faut les former et confier leur supervision à un chercheur ou à un gestionnaire expérimenté. Quand plus d’un enquêteur s’occupe d’une étude, la formation revêt une importance particulière parce qu’il faut s’assurer que les questions sont présentées et les réponses interprétées d’une façon uniforme. Dans de nombreux projets de recherche, la formation est donnée en groupe et répétée périodiquement (par exemple, chaque année). Les séminaires de formation couvrent habituellement en détail les sujets suivants:
La supervision de l’étude comporte souvent une observation sur le terrain, qui peut comprendre l’enregistrement sur bande des entrevues pour étude ultérieure. Il est courant pour le superviseur de revoir personnellement chaque questionnaire avant de le transmettre à la saisie des données. De plus, il fixe et fait respecter des normes de rendement pour les enquêteurs et, dans certaines études, il procède à de nouvelles entrevues indépendantes ou entrevues de contrôle avec quelques participants pour vérifier la fiabilité.
La distribution des questionnaires aux participants et leur récupération ultérieure pour analyse sont réalisées par l’un des trois moyens décrits plus haut: par contact personnel, par courrier, par téléphone. Certains chercheurs organisent eux-mêmes ces travaux et vont parfois jusqu’à s’en occuper en personne dans leurs propres établissements. Si un chercheur principal a beaucoup de mérite à s’intéresser ainsi à la dynamique des entrevues, il est à la fois plus rentable et plus avantageux du point de vue du maintien d’une haute qualité de données d’inclure dans l’équipe de recherche des enquêteurs professionnels bien formés et bien supervisés.
Certains chercheurs s’adjoignent par contrat les services de sociétés spécialisées dans les enquêtes, qui peuvent se charger de diverses fonctions: distribution et récupération des questionnaires, réalisation des entrevues téléphoniques ou directes, obtention d’échantillons biologiques (sang, urine), gestion des données, analyse statistique et rédaction du rapport. Indépendamment du niveau d’intervention, les sociétés engagées à contrat doivent habituellement fournir des renseignements sur le taux de réponse et la qualité des données. Toutefois, c’est le chercheur qui assume la responsabilité finale de l’intégrité scientifique de l’étude.
On peut évaluer la qualité des données en reprenant les entrevues avec un échantillon des participants à l’étude d’origine. On peut ainsi établir la fiabilité des entrevues initiales et estimer la répétabilité des réponses. Il n’est pas nécessaire de repasser tout le questionnaire, une partie des questions suffisant en général. On dispose de tests statistiques pour évaluer la fiabilité d’une série de questions posées à un même participant à des moments différents, des réponses fournies par différents participants et même des questions posées par différents enquêteurs (fiabilité interenquêteurs et intra-enquêteurs).
Les progrès de la technologie informatique ont permis de mettre au point différents moyens de saisir les données inscrites sur les questionnaires et de les mettre à la disposition du chercheur, pour analyse informatique. Il existe trois façons fondamentalement différentes de saisir les données: en temps réel (au fur et à mesure que le participant répond au cours de l’entrevue), par introduction traditionnelle au clavier et par lecture optique.
De nombreux chercheurs se servent aujourd’hui d’ordinateurs pour recueillir les réponses aux questions posées en entrevue directe ou téléphonique. Les chercheurs sur le terrain trouvent commode d’utiliser des ordinateurs portables programmés pour afficher les questions en séquence et permettre à l’enquêteur d’entrer immédiatement la réponse. Les sociétés de recherche par sondage qui réalisent les entrevues téléphoniques ont développé des moyens analogues appelés systèmes d’entrevues téléphoniques assistées par ordinateur (ETAO). Ces méthodes ont deux avantages importants par rapport au traditionnel questionnaire sur papier. Premièrement, les réponses peuvent être instantanément vérifiées par rapport à une liste de réponses permises et contrôlées du point de vue de leur cohérence avec les réponses précédentes, les divergences pouvant ainsi être immédiatement portées à l’attention de l’enquêteur et de l’enquêté, d’où un taux d’erreur sensiblement inférieur. Deuxièmement, les séquences de questions qui dépendent des réponses données sont programmées d’avance, ce qui réduit le temps d’administration du questionnaire.
La méthode la plus répandue d’introduction des données demeure toujours la traditionnelle saisie au clavier par un opérateur expérimenté. Pour les très grandes études, les questionnaires sont habituellement envoyés à une entreprise sous-traitante spécialisée dans la saisie de données. Ces sociétés utilisent souvent un équipement spécialisé qui permet à un opérateur de saisir au clavier un questionnaire et à un second opérateur de ressaisir les mêmes données, à la suite de quoi les résultats de la seconde saisie sont comparés à ceux de la première pour s’assurer que les données ont été entrées correctement. Des procédures d’assurance de la qualité peuvent être programmées pour vérifier que chaque réponse se situe dans la plage permise et qu’elle concorde avec les autres réponses. Les fichiers de données résultants sont alors transmis au chercheur sur disque, sur bande ou par téléphone ou réseau informatique, sous forme d’un signal électronique.
Pour les petites études, il existe de nombreux programmes commerciaux pour micro-ordinateurs, qui offrent des fonctions d’entrée de données semblables à celles des systèmes spécialisés. Les logiciels en question comprennent des programmes de gestion de bases de données (dBase, Foxpro, Microsoft Access) et des tableurs (Microsoft Excel, Lotus 1-2-3). De plus, des fonctions d’entrée de données sont incluses dans de nombreux logiciels dont l’objet principal est l’analyse statistique (SPSS, BMDP, EPI INFO).
La saisie optique est aussi une méthode largement répandue d’enregistrement des données, qui convient pour certains questionnaires spécialisés. La lecture optique de marques ou détection optique permet de lire les questionnaires sur lesquels les participants ont inscrit leurs réponses en noircissant de petits rectangles ou cercles. Cette méthode est efficace lorsque chaque sujet remplit son propre questionnaire. Certains matériels plus perfectionnés et coûteux peuvent reconnaître l’écriture manuscrite, mais jusqu’ici cette technique ne permet pas encore de faire une saisie efficace des données dans des études à grande échelle.
Parce que l’information est une ressource de grande valeur qui est sujette à l’interprétation et à d’autres influences, les chercheurs sont parfois invités à partager leurs données avec d’autres. La demande de partage des données peut être motivée par une multitude de raisons, allant du désir de reproduire certains résultats à la crainte que les données n’aient fait l’objet d’erreurs d’analyse ou d’interprétation.
Lorsqu’on soupçonne que des données ont été falsifiées ou fabriquées de toutes pièces, il devient essentiel de pouvoir soumettre les documents originaux sur lesquels elles se basent à une vérification. Outre les questionnaires originaux et les fichiers informatiques de données brutes, le chercheur doit être en mesure de produire pour inspection les manuels de codage établis pour l’étude et les registres dans lesquels ont été inscrites toutes les modifications apportées en cours de codage, de saisie et d’analyse. Par exemple, si une donnée a été modifiée parce qu’elle avait initialement semblé aberrante, la modification et son motif devraient figurer sur un registre établi pour permettre des vérifications ultérieures. Ce type d’information est également précieux lors de la rédaction du rapport parce qu’il sert d’aide-mémoire permettant de déterminer comment ont été traitées les données sur lesquelles se fondent les conclusions que l’on se prépare à publier.
Pour ces raisons, le chercheur a l’obligation, lors de l’achèvement d’une étude, de s’assurer que toutes les données de base sont archivées pour une période appropriée et peuvent être retrouvées s’il est appelé à les produire.
Divers exemples de risques professionnels sont souvent cités non seulement pour illustrer les troubles de santé qui peuvent être liés aux expositions en milieu de travail, mais aussi pour montrer qu’une approche systématique de l’étude de populations de travailleurs peut mettre en évidence des associations significatives entre expositions et morbidité. L’amiante en est un exemple. Lawrence Garfinkel a écrit un article qui montre avec quelle élégance, mais aussi avec quelle simplicité, le défunt docteur Irving J. Selikoff a établi le risque élevé de cancer parmi les travailleurs de l’amiante. L’article est reproduit ici avec quelques modifications mineures, avec l’autorisation du CA-A Cancer Journal for Clinicians (Garfinkel, 1988). Les tableaux sont tirés de l’article original écrit par le docteur Selikoff et ses collaborateurs (1964).
L’exposition à l’amiante est devenue un problème majeur de santé publique, dont les ramifications vont au-delà du champ d’intérêt immédiat des professionnels de la santé, pour s’étendre aux domaines du législateur, du juge, de l’avocat, de l’éducateur et d’autres responsables de la collectivité. De ce fait, les maladies liées à l’amiante préoccupent de plus en plus aussi bien les cliniciens et les responsables de la santé que les consommateurs et le grand public.
L’amiante est un minéral très utile qui a été utilisé de multiples façons depuis des temps immémoriaux. Des études archéologiques en Finlande ont mis en évidence la présence de fibres d’amiante dans des poteries datant de 2 500 ans avant J.-C. On s’en servait pour faire des mèches de lampe au Ve siècle avant J.C. Aux environs de 456 avant J.-C., Hérodote a mentionné l’emploi du tissu d’amiante pour l’incinération. L’amiante a été utilisé dans l’armure des soldats au XVe siècle et, vers 1720, il entrait dans la fabrication de tissus, de gants, de chaussettes et de sacs à main en Russie. Bien que l’on ne sache pas exactement quand a été perfectionné l’art du tissage de l’amiante, on sait que les Anciens le travaillaient beaucoup avec le lin. La production commerciale de ce minéral a débuté en Italie vers 1850; il servait alors dans la fabrication du papier et des tissus.
Le développement de l’exploitation des mines d’amiante au Canada et en Afrique du Sud vers 1880 a fait baisser les coûts de production et a stimulé la fabrication de produits à base d’amiante. Son extraction et sa production aux Etats-Unis, en Italie et en Russie ont rapidement suivi. Aux Etats-Unis, l’utilisation de l’amiante comme isolant de canalisations a encouragé la production et, peu après, on s’en est servi dans diverses autres applications, notamment les garnitures de freins, les canalisations en ciment, les vêtements de protection, etc.
La production aux Etats-Unis est passée de 6 000 tonnes environ en 1900 à 650 000 tonnes en 1975, pour chuter ensuite de 300 000 à 33 000 tonnes entre 1982 et 1994.
On rapporte que Pline le Jeune (61-113 après J.-C.) parle, dans ses écrits, d’esclaves qui étaient tombés malades après avoir travaillé l’amiante. On mentionnait déjà au XVIe siècle des pathologies professionnelles liées à l’extraction minière, mais le premier constat de fibrose pulmonaire chez un ouvrier de l’amiante a été dressé en 1906, en Angleterre. On a rapporté peu après un nombre anormal de décès en France et en Italie, parmi les ouvriers travaillant dans les applications industrielles de l’amiante, mais il a fallu attendre 1924 pour que soit clairement reconnue en Angleterre la pathologie provoquée par l’amiante. En 1930, Bois et Gloyne avaient rapporté trente-sept cas de fibrose pulmonaire.
La première mention du carcinome du poumon chez un malade atteint de «silicose de l’amiante» a paru en 1935. Plusieurs autres cas ont été rapportés par la suite. Des taux élevés de cancer du poumon chez des malades morts d’asbestose ont été signalés en 1947, 1949 et 1951. En 1955, en Angleterre, Richard Doll a signalé l’existence d’un risque anormal de cancer du poumon chez les personnes ayant travaillé dans une usine d’amiante à partir de 1935, avec un risque particulièrement élevé chez ceux qui avaient été employés pendant plus de vingt ans.
C’est dans ce contexte que le docteur Irving Selikoff a fait ses premières observations cliniques de la pathologie liée à l’amiante. Le docteur Selikoff était alors un scientifique distingué. Ses réalisations précédentes comprenaient le développement de l’isoniazide et sa première utilisation dans le traitement de la tuberculose, pour lesquels il a reçu le Prix Lasker en 1952.
Au début des années soixante, en tant que pneumologue pratiquant à Paterson (New Jersey), il observe de nombreux cas de cancer du poumon chez les ouvriers d’une usine d’amiante de la région. Il décide alors d’étendre ses observations à deux sections du syndicat des travailleurs de l’isolation d’amiante dont les membres aussi avaient été exposés aux fibres d’amiante. S’étant aperçu que beaucoup de gens ne croyaient pas encore que le cancer du poumon était lié à l’exposition à l’amiante, il comprend que seule une étude approfondie sur l’ensemble d’une population exposée pourrait les convaincre. Il se pouvait que l’exposition à l’amiante dans la population soit en rapport avec d’autres types de cancer, tels que le mésothéliome pleural ou péritonéal, comme quelques études l’avaient suggéré. La plupart des études des effets de l’amiante sur la santé menées dans le passé avaient porté sur des travailleurs des mines et des usines d’amiante. Il était important de savoir si l’inhalation des fibres avait également affecté d’autres groupes exposés à l’amiante.
Ayant entendu parler des réalisations du docteur E. Cuyler Hammond, alors directeur de la section de recherche statistique de la Société américaine du cancer (American Cancer Society (ACS)), le docteur Selikoff décide de lui proposer de collaborer à la conception et à l’analyse d’une étude. Le docteur Hammond avait publié quelques années plus tôt une étude prospective, qui devait faire date, sur le tabagisme et la santé.
Le docteur Hammond voit immédiatement l’importance possible d’une étude portant sur les ouvriers de l’amiante. Bien qu’il soit alors très occupé par l’analyse des données de la nouvelle étude prospective de l’ACS sur la prévention du cancer (Cancer Prevention Study I ou CPS I), qu’il avait entreprise quelques années plus tôt, il consent volontiers à collaborer pendant ses «loisirs». Il propose de limiter l’analyse aux ouvriers ayant au moins vingt ans d’ancienneté, qui auraient donc subi une exposition maximale à l’amiante.
Madame Janet Kaffenburgh, attachée de recherche du docteur Selikoff à l’hôpital Mount Sinai de New York, se joint à l’équipe. Elle travaille avec le docteur Hammond à la préparation des listes des sujets de sexe masculin à inclure dans l’étude, recherchant leur âge, leur date d’embauche, ainsi que les circonstances et les causes de leur décès. Elle tire des registres de la direction du syndicat les données sur les circonstances et les causes des décès. Cette information est ensuite recopiée sur des fiches cartonnées, qui sont ensuite littéralement triées à même le sol du salon du docteur Hammond, par Mme Kaffenburgh et lui-même.
Le docteur Jacob Churg, pathologiste du Barnert Memorial Hospital Center de Paterson (New Jersey), assure le contrôle pathologique des causes de décès.
L’étude résultante appartient à la classe des «enquêtes prospectives menées rétrospectivement». La qualité des registres du syndicat a permis l’analyse d’une étude à long terme pendant une période relativement brève. Bien que 632 hommes seulement aient été retenus pour l’étude, les données correspondaient en réalité à l’équivalent de 8 737 années-personnes d’exposition (voir tableau 28.16); 255 décès ont été dénombrés pendant les vingt années de la période d’observation, de 1943 à 1962 (voir tableau 28.17). C’est dans ce dernier tableau que l’on peut constater que le nombre observé de décès dépasse invariablement le nombre attendu, ce qui met en évidence l’association entre l’exposition professionnelle à l’amiante et un taux élevé de mortalité par cancer.
|
Age |
Période |
|||
|
1943-1947 |
1948-1952 |
1953-1957 |
1958-1962 |
|
|
35–39 |
85,0 |
185,0 |
7,0 |
11,0 |
|
40–44 |
230,5 |
486,5 |
291,5 |
70,0 |
|
45–49 |
339,5 |
324,0 |
530,0 |
314,5 |
|
50–54 |
391,5 |
364,0 |
308,0 |
502,5 |
|
55–59 |
382,0 |
390,0 |
316,0 |
268,5 |
|
60–64 |
221,0 |
341,5 |
344,0 |
255,0 |
|
65–69 |
139,0 |
181,0 |
286,0 |
280,0 |
|
70–74 |
83,0 |
115,5 |
137,0 |
197,5 |
|
75–79 |
31,5 |
70,0 |
70,5 |
75,0 |
|
80–84 |
5,5 |
18,5 |
38,5 |
23,5 |
|
85+ |
3,5 |
2,0 |
8,0 |
13,5 |
|
Total |
1 912,0 |
2 478,0 |
2 336,5 |
2 011,0 |
|
Cause du décès |
Période d’observation |
Total |
|||
|
1943-1947 |
1948-1952 |
1953-1957 |
1958-1962 |
1943-1962 |
|
|
Total, toutes causes confondues |
|||||
|
Observés (travailleurs de l’amiante) |
28,0 |
54,0 |
85,0 |
88,0 |
255,0 |
|
Attendus (Américains, hommes, de race blanche) |
39,7 |
50,8 |
56,6 |
54,4 |
203,5 |
|
Total, cancer, toutes localisations |
|||||
|
Observés (travailleurs de l’amiante) |
13,0 |
17,0 |
26,0 |
39,0 |
95,0 |
|
Attendus (Américains, hommes, de race blanche) |
5,7 |
8,1 |
13,0 |
9,7 |
36,5 |
|
Cancer du poumon et de la plèvre |
|||||
|
Observés (travailleurs de l’amiante |
6,0 |
8,0 |
13,0 |
18,0 |
45,0 |
|
Attendus (Américains, hommes, de race blanche) |
0,8 |
1,4 |
2,0 |
2,4 |
6,6 |
|
Cancer de l’estomac, du côlon et du rectum |
|||||
|
Observés (travailleurs de l’amiante) |
4,0 |
4,0 |
7,0 |
14,0 |
29,0 |
|
Attendus (Américains, hommes, de race blanche) |
2,0 |
2,5 |
2,6 |
2,3 |
9,4 |
|
Cancer, toutes autres localisations réunies |
|||||
|
Observés (travailleurs de l’amiante) |
3,0 |
5,0 |
6,0 |
7,0 |
21,0 |
|
Attendus (Américains, hommes, de race blanche) |
2,9 |
4,2 |
8,4 |
5,0 |
20,5 |
Ces travaux ont constitué une étape décisive dans notre connaissance de la pathologie liée à l’amiante et a orienté la direction de la recherche future. L’article publiée à cette occasion a été cité dans des publications scientifiques au moins 261 fois depuis sa première parution. Avec le soutien financier de l’ACS et des Instituts nationaux de la santé (National Institutes of Health ((NIH)) des Etats-Unis, les docteurs Selikoff et Hammond et leur équipe grandissante de minéralogistes, de pneumologues, de radiologues, de pathologistes, d’hygiénistes et d’épidémiologistes ont continué à explorer différentes facettes de la pathologie de l’amiante.
Un article essentiel de 1968 a rapporté les effets synergiques de la consommation de cigarettes et de l’exposition à l’amiante (Selikoff, Hammond et Churg, 1968). Les études ont été étendues aux travailleurs de production de l’amiante, à des sujets qui y sont indirectement exposés dans leur milieu de travail (travailleurs des chantiers navals, par exemple) et à d’autres dont la famille a été exposée à l’amiante.
Dans une analyse ultérieure, à laquelle a également participé Herbert Seidman, MBA, vice-président adjoint de la division épidémiologie et statistique de l’ACS, le groupe a démontré qu’une exposition à l’amiante, même de courte durée, provoque une augmentation considérable du risque de cancer, jusqu’à trente années plus tard (Seidman, Selikoff et Hammond, 1979). La première étude portant sur 632 travailleurs de l’isolation n’avait recensé que trois cas de mésothéliome, mais les enquêtes ultérieures ont montré que 8% de tous les décès parmi les travailleurs de l’amiante étaient dus aux mésothéliomes pleural et péritonéal.
A mesure que s’étendaient leurs investigations scientifiques, le docteur Selikoff et ses collaborateurs ont beaucoup contribué à la réduction de l’exposition à l’amiante. Ils ont notamment favorisé l’adoption d’innovations dans les techniques d’hygiène industrielle, persuadé les législateurs de l’urgence du problème de l’amiante, établi un système d’évaluation des demandes de réparation des travailleurs victimes d’une maladie due à l’amiante et étudié la répartition générale des particules d’amiante dans l’eau et l’air ambiant.
Le docteur Selikoff a aussi attiré l’attention de la communauté médicale et scientifique sur le dossier de l’amiante en organisant des conférences et en participant à de nombreuses réunions scientifiques. Beaucoup des rencontres d’orientation qu’il a organisées sur la question de la pathologie de l’amiante s’adressaient en particulier à des avocats, des juges, des directeurs de grandes sociétés et des cadres de l’assurance.