

Les rayonnements ionisants sont partout dans l’univers. Ils viennent de l’espace sous forme de rayons cosmiques. Ils sont émis dans l’atmosphère par le radon et ses descendants radioactifs. Les radio-isotopes naturels pénètrent tous les tissus vivants et y restent. Aucun être vivant ne peut y échapper. En fait, l’évolution de toutes les espèces de la planète s’est faite grâce à la présence de rayonnements ionisants. Même si les effets biologiques de petites doses de rayonnement ne sont pas immédiatement apparents chez des humains exposés, il n’y a pas de doute qu’à partir d’une certaine intensité les rayonnements ionisants sont nuisibles. Leurs effets sont bien connus, tant en nature qu’en gravité.
S’il est vrai que les rayonnements ionisants peuvent être dommageables, ils ont, par contre, de multiples applications utiles. L’uranium radioactif produit de l’électricité dans les centrales nucléaires de nombreux pays. En médecine, les rayons X permettent de prendre des radiographies qui servent à diagnostiquer des maladies et des lésions internes. Les spécialistes de la médecine nucléaire se servent de produits radioactifs comme traceurs pour former des images détaillées de structures internes et pour étudier le métabolisme. Il existe des produits radiopharmaceutiques permettant de traiter des maladies telles que l’hyperthyroïdie et le cancer. Les radiothérapeutes ont recours aux rayons gamma, aux faisceaux de pions et d’électrons, aux neutrons et à d’autres types de rayonnement pour traiter les tumeurs cancéreuses. Les ingénieurs utilisent des éléments radioactifs pour faire des diagraphies des puits de pétrole et se servent de nucléodensimètres pour mesurer la densité des sols. Les radiographes industriels emploient les rayons X en contrôle de la qualité pour observer la structure interne des produits manufacturés. Dans les immeubles et les avions, les panneaux indiquant les sorties et les issues de secours portent des inscriptions au tritium radioactif qui les rend visibles dans l’obscurité en cas de panne de courant. D’innombrables logements et locaux commerciaux sont protégés par des détecteurs de fumée fonctionnant à l’américium radioactif.
Par leurs nombreuses applications, les rayonnements ionisants et les matières radioactives améliorent notre qualité de vie et aident la société de bien des façons. Bien sûr, nous devons toujours comparer les avantages de chaque application à ses risques. Ces derniers ne concernent pas seulement les travailleurs qui manipulent directement les rayonnements ou les substances radioactives, mais aussi le public, les générations futures et l’environnement. Au-delà des considérations politiques et économiques, lorsqu’il s’agit d’utiliser les rayonnements ionisants, il faut toujours que les avantages l’emportent de loin sur les risques.
Les rayonnements ionisants consistent en particules, y compris des photons, qui arrachent des électrons à des atomes et des molécules. Toutefois, certains rayonnements d’énergie relativement faible, comme les rayons ultraviolets, peuvent être ionisants dans des conditions particulières. Pour les distinguer des rayonnements qui provoquent toujours l’ionisation, on définit un seuil arbitraire d’énergie, en général 10 kiloélectronvolts (keV), à partir duquel les rayonnements sont dits ionisants.
Les rayonnements directement ionisants consistent en particules chargées: électrons énergétiques (parfois appelés négatons), positons, protons, particules alpha, mésons chargés, muons et ions lourds (atomes ionisés). Les rayonnements de ce type agissent sur la matière en vertu de la loi de Coulomb, leur charge attirant ou repoussant les électrons qui gravitent autour des atomes et des molécules.
Les rayonnements indirectement ionisants consistent en particules neutres; les plus courants étant les photons de plus de 10 keV (rayons X et gamma) et tous les neutrons.
Les photons des rayons X et gamma provoquent l’ionisation de la matière d’au moins trois manières différentes:
Un photon donné peut produire n’importe laquelle des formes d’ionisation mentionnées ci-dessus, sauf que la production de paires n’est possible que si son énergie est supérieure à 1,02 MeV. L’énergie du photon et la matière sur laquelle il agit déterminent le genre d’ionisation le plus susceptible de se produire.
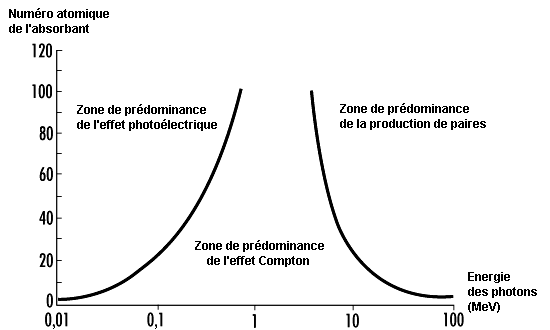
La figure 48.1 montre les régions dans lesquelles chaque type d’interaction domine en fonction de l’énergie du photon et du numéro atomique de la cible.
Les interactions les plus courantes des neutrons sont les chocs inélastiques, la capture de neutrons (ou activation) et la fission. Il s’agit dans tous les cas d’interactions avec des noyaux. A la suite d’un choc inélastique avec un neutron, un noyau passe à un niveau supérieur d’énergie. Il peut libérer cette énergie en émettant un rayonnement gamma, une particule bêta ou les deux. En cas de capture du neutron, le noyau touché peut absorber le neutron incident et libérer de l’énergie sous forme de rayons X ou gamma, de particules bêta ou les deux. Les particules secondaires provoquent ensuite l’ionisation, comme on l’a expliqué plus haut. Dans le cas de la fission, un noyau lourd absorbe le neutron incident puis se divise en deux noyaux plus légers qui sont presque toujours radioactifs.
La Commission internationale des unités et mesures radiologiques (International Commission on Radiation Units and Measurements (ICRU)) élabore des définitions officielles acceptées à l’échelle internationale des quantités et unités de rayonnement et de radioactivité. La Commission internationale de protection radiologique (CIPR) formule également les normes de définition et d’utilisation des diverses quantités et unités employées en radioprotection. Nous présentons dans ce qui suit une description de quelques-unes des quantités, unités et définitions d’utilisation courante dans ce domaine.
Activité . Cette quantité représente le nombre de transformations radioactives par unité de temps à partir d’un niveau d’énergie donné, selon la formule:
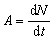
A étant l’activité et dN le nombre probable de transformations radioactives spontanées à partir du niveau d’énergie donné dans l’intervalle de temps dτ. L’activité est liée au nombre N de noyaux radioactifs par la formule:
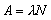
dans laquelle λ est la constante de désintégration. L’activité s’exprime en secondes inverses (s–1), l’unité spécifique étant le becquerel (Bq).
Constante de désintégration (λ). Pour un radionucléide donné, la constante de désintégration (également dite constante radioactive ) est la probabilité par unité de temps qu’une transformation radioactive se produise. La constante de désintégration s’exprime en secondes inverses (s–1). Elle est liée à la période radioactive t½ d’un radionucléide par la formule:
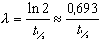
La constante de désintégration λ est liée à la vie moyenne τ d’un radionucléide par la formule:
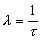
L’activité A(t) et le nombre de noyaux radioactifs N(t) peuvent être exprimés en fonction du temps par les formules Α(0)e–λt et N(0)e–λt, respectivement.
Dose absorbée . C’est la quantité fondamentale de la dosimétrie des rayonnements ionisants. Il s’agit essentiellement de l’énergie que les rayonnements ionisants cèdent à la matière par unité de masse. La formule de la dose absorbée est la suivante:
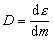
D étant la dose absorbée et dε l’énergie moyenne cédée à la matière de masse dm. La dose absorbée s’exprime en joules par kilogramme (J kg–1), l’unité spécifique étant le gray (Gy).
Effet biologique déterministe . C’est l’effet biologique des rayonnements ionisants dont la probabilité est nulle lorsque la dose absorbée est petite, mais passe très rapidement à l’unité (100%) au-delà d’un certain niveau de dose absorbée (seuil). L’induction d’une cataracte est un exemple d’effet biologique déterministe.
Effet biologique stochastique ou probabiliste . C’est un effet biologique des rayonnements ionisants, dont la probabilité augmente avec la dose absorbée, vraisemblablement sans qu’il existe un seuil, mais dont la gravité est indépendante de cette dose. Le cancer est un exemple d’effet biologique stochastique.
Efficacité biologique relative (EBR) . L’EBR d’un rayonnement par rapport à un autre est le rapport inverse des doses absorbées produisant le même degré d’un résultat biologique défini.
Equivalent de dose . L’équivalent de dose HT est la dose absorbée en moyenne pour tout un tissu ou organe (par opposition à la dose absorbée en un point) et pondérée en fonction du facteur de qualité du rayonnement considéré. C’est une quantité relevant de la radioprotection, qu’il ne convient donc pas d’utiliser dans le cas des doses absorbées élevées reçues en un laps de temps relativement court. L’équivalent de dose est exprimé par la formule:
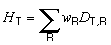
DT,R étant la dose absorbée moyenne pour tout tissu ou organe T attribuable au rayonnement R, et wR le facteur de pondération du rayonnement. L’équivalent de dose est exprimé en joules par kilogramme (J kg–1), l’unité spécifique étant le sievert (Sv).
Equivalent de dose efficace . L’équivalent de dose efficace E est la somme des équivalents pondérés de dose dans tous les tissus ou organes du corps. C’est une quantité relevant de la radioprotection, qu’il ne convient donc pas d’utiliser dans le cas de doses absorbées élevées reçues en un laps de temps relativement court. Elle est exprimée par la formule:
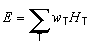
wT étant le facteur de pondération pour le tissu et HT, l’équivalent de dose pour le tissu T. La dose efficace s’exprime en joules par kilogramme (J kg–1), l’unité spécifique étant le sievert (Sv).
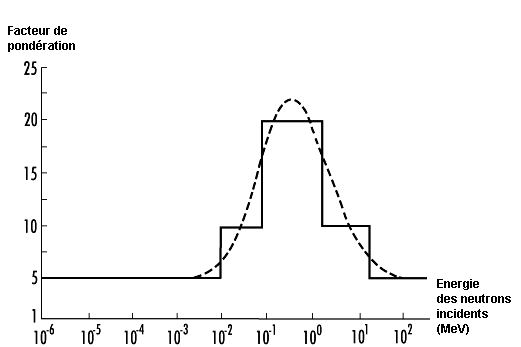
Facteur de pondération des rayonnements . Il s’agit d’un nombre wR qui, pour un type donné et une énergie donnée d’un rayonnement R, est représentatif des valeurs de l’efficacité biologique relative avec laquelle ce rayonnement peut provoquer des effets stochastiques à faible dose. Les valeurs de wR sont liées au transfert linéique d’énergie TLE ou TEL selon les publications. Elles sont indiquées dans le tableau 48.1. La figure 48.2 illustre la relation entre wR et le TLE dans le cas des neutrons.
|
Type de rayonnement et gamme d’énergie |
wR |
|
Photons, toutes énergies |
1 |
|
Electrons et muons, toutes énergies2 |
1 |
|
Neutrons, énergie <10 keV |
5 |
|
10 keV à 100 keV |
10 |
|
>100 keV à 2 MeV |
20 |
|
>2 MeV à 20 MeV |
10 |
|
>20 MeV |
5 |
|
Protons (sauf protons de recul), énergie >2 MeV |
5 |
|
Particules alpha, fragments de fission, noyaux lourds |
20 |
1 Toutes les valeurs se rapportent au rayonnement incident sur le corps ou, dans le cas des sources internes, au rayonnement émis à partir de la source.2 A l’exception des électrons Auger émis par des noyaux liés à l’ADN.
Facteur de pondération des tissus wT. Nombre représentant la contribution du tissu ou de l’organe T au détriment total dû à l’ensemble des effets stochastiques résultant d’une irradiation uniforme de tout le corps. La raison d’être de ce facteur est que la probabilité des effets stochastiques dus à un équivalent de dose dépend du tissu ou de l’organe irradié. Un équivalent de dose uniforme appliqué à tout le corps devrait donner une dose efficace numériquement égale à la somme des doses efficaces pour tous les tissus et organes du corps. Par conséquent, la somme de tous les facteurs de pondération des tissus est normalisée à l’unité. Le tableau 48.2 présente les facteurs de pondération pour différents tissus et organes.
|
Tissu ou organe |
wT |
|
Gonades |
0,20 |
|
Moelle osseuse (rouge) |
0,12 |
|
Côlon |
0,12 |
|
Poumon |
0,12 |
|
Estomac |
0,12 |
|
Vessie |
0,05 |
|
Sein |
0,05 |
|
Foie |
0,05 |
|
Œsophage |
0,05 |
|
Thyroïde |
0,05 |
|
Peau |
0,01 |
|
Surface des os |
0,01 |
|
Autres tissus et organes |
0,052, 3 |
1 Ces valeurs ont été calculées pour une population de référence composée d’un nombre égal d’hommes et de femmes dans une large fourchette d’âge. Dans la définition de la dose efficace, les valeurs s’appliquent aux travailleurs, à l’ensemble de la population et aux deux sexes.2 Pour fins de calcul, la catégorie «Autres tissus et organes» comprend ce qui suit: surrénales, cerveau, côlon ascendant supérieur, intestin grêle, reins, muscles, pancréas, rate, thymus et utérus. Cette liste inclut les organes qui peuvent être sélectivement irradiés. Certains de ces organes sont connus comme susceptibles d’induction de cancer.3 Dans les cas exceptionnels où un seul des tissus ou organes de la catégorie «Autres tissus et organes» reçoit un équivalent de dose supérieur à la plus haute dose dans l’un quelconque des douze organes dont le facteur de pondération est défini, on lui attribuera un facteur de pondération de 0,025 et on attribuera un facteur de pondération de 0,025 à la dose moyenne des autres tissus et organes de cette même catégorie.
Période radioactive . La période radioactive (parfois appelée demi-vie ) est le temps nécessaire pour que l’activité d’un radionucléide donné diminue de moitié. On peut également dire que la période radioactive est égale au temps nécessaire pour que le nombre de noyaux, dans un système radioactif donné, diminue de moitié. L’unité fondamentale est la seconde (s), mais la période est aussi couramment exprimée en heures, en jours et en années. Pour un radionucléide donné, la période t½ est liée à la constante de désintégration λ par la formule:
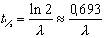
Transfert linéique d’énergie. C’est l’énergie qu’une particule chargée transmet à la matière qu’elle traverse par unité de longueur de la trajectoire suivie. Elle est exprimée par la formule:
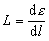
L étant le transfert linéique d’énergie et dε, l’énergie moyenne cédée par la particule après avoir franchi la distance dl. Le transfert linéique d’énergie (TLE ou TEL) s’exprime en joules par mètre (J m–1).
Vie moyenne . La vie moyenne ou durée moyenne de vie est égale au temps moyen pendant lequel un état nucléaire peut survivre avant de subir une transformation qui l’amènera à un niveau d’énergie inférieur avec émission d’un rayonnement ionisant. L’unité fondamentale est la seconde (s), mais la vie moyenne est aussi couramment exprimée en heures, en jours et en années. Elle est liée à la constante de désintégration par la formule:
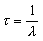
τ étant la vie moyenne et λ, la constante de désintégration pour un nucléide donné à un niveau d’énergie donné.
|
L’étendue des sujets relatifs aux rayonnements ionisants traités dans ce chapitre permet au lecteur de découvrir la plupart des problèmes posés par la protection radiologique et l’invite à rechercher des compléments d’information dans des ouvrages spécialisés. Les lecteurs francophones souhaiteront prendre connaissance des directives EURATOM auxquelles chaque pays de l’Union européenne (UE) doit se soumettre; ces directives sont inspirées des recommandations de la Commission internationale de protection radiologique (CIPR) que les auteurs ont souvent rappelées tout au long du texte. A toutes fins utiles, on retiendra que dès le 1er mai 2000, la nouvelle directive 96/29 EURATOM aura dû être mise en application dans tous les pays concernés. Elle fixe «les normes de base relatives à la protection sanitaire de la population et des travailleurs contre les dangers résultant des rayonnements ionisants» (CCE, 1996). Bernard Le Guen |
Après leur découverte par Röntgen en 1895, les rayons X ont été adoptés si rapidement dans le diagnostic et le traitement des maladies que les lésions dues à une exposition excessive ont presque immédiatement fait leur apparition chez les pionniers du domaine, qui n’étaient pas encore conscients des risques qu’ils encouraient (Brown, 1933). Au début, les lésions consistaient essentiellement en réactions cutanées sur les mains de ceux qui manipulaient les premiers appareils à rayons X. Une dizaine d’années plus tard, beaucoup d’autres lésions étaient signalées, y compris les premiers cancers attribués aux rayonnements (Stone, 1959).
Depuis ces premières constatations, l’étude des effets biologiques des rayonnements ionisants a constamment reçu des impulsions nouvelles du fait de leur utilisation croissante en médecine, en sciences et dans l’industrie, ainsi que dans les applications pacifiques et militaires de l’énergie nucléaire. C’est ce qui explique que les effets biologiques des rayonnements aient fait l’objet d’investigations beaucoup plus approfondies que ceux de tout autre agent extérieur. D’ailleurs, les connaissances radiobiologiques acquises ont beaucoup contribué aux actions entreprises pour protéger la santé humaine contre bien d’autres risques liés à l’environnement.
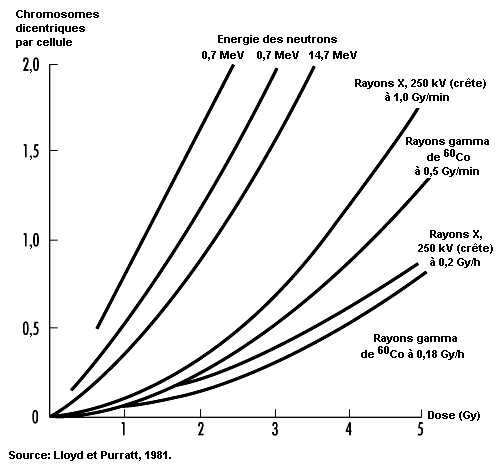
Energie communiquée au milieu . Contrairement aux autres formes de rayonnement, les rayonnements ionisants peuvent transmettre suffisamment d’énergie localement pour éjecter des électrons des atomes sur lesquels ils agissent. Ainsi, à mesure que les particules ionisantes heurtent de façon aléatoire des atomes et des molécules en passant à travers des cellules vivantes, elles donnent naissance à des ions et à des radicaux libres qui rompent les liaisons chimiques et provoquent d’autres transformations moléculaires qui endommagent les cellules touchées. La répartition spatiale de l’ionisation dépend du facteur de pondération du rayonnement wR (voir tableau 48.1 et figure 48.3).
Effets sur l’ADN . Le rayonnement peut altérer toute molécule de la cellule, mais l’ADN est la cible biologique la plus critique à cause de la redondance limitée de l’information génétique qu’il contient. Une dose absorbée assez importante pour tuer une cellule moyenne en voie de division — 2 grays (Gy) — suffit pour causer des centaines de lésions dans ses molécules d’ADN (Ward, 1988). La plupart de ces lésions sont réparables, mais celles qui résultent d’un rayonnement ionisant dense (proton ou particule alpha, par exemple) sont en général moins susceptibles de réparation que celles d’un rayonnement moins ionisant (rayons X ou gamma, par exemple) (Goodhead, 1988). Par conséquent, les rayonnements à forte densité d’ionisation (c’est-à-dire à transfert linéique d’énergie (TLE) élevé) ont ordinairement une efficacité biologique relative (EBR) supérieure à celle des rayonnements à faible densité d’ionisation (à TLE peu élevé) pour la plupart des lésions (CIPR, 1991).
Effets sur les gènes . Les dommages non réparables ou mal réparés subis par l’ADN peuvent donner lieu à des mutations dont la fréquence semble croître de façon linéaire avec la dose, à environ 10–5 à 10–6 par locus et par Gy, sans qu’il existe apparemment de seuil (Committee on the Biological Effects of Ionizing Radiations (BEIR V), 1990). Pour certains experts, cette proportionnalité apparente entre le taux de mutation et la dose signifierait que le passage d’une seule particule ionisante à travers l’ADN suffit en principe pour causer une mutation (BEIR V, 1990). Chez les victimes de la catastrophe de Tchernobyl, la relation dose-effet observée pour les mutations de la glycophorine dans les cellules de moelle osseuse ressemble étroitement à celle que l’on a mise en évidence chez les survivants des bombardements atomiques (Jensen et coll., 1995).
Effets sur les chromosomes . Les dommages causés par les rayonnements ionisants aux matériaux génétiques peuvent également provoquer des modifications du nombre et de la structure des chromosomes, dont on a observé que la fréquence augmentait avec la dose chez les travailleurs exposés aux rayonnements ionisants, les survivants des bombardements atomiques et d’autres personnes également exposées. La relation dose-effet correspondant aux aberrations chromosomiques des lymphocytes sanguins humains (voir figure 48.4) a été suffisamment bien caractérisée pour constituer un moyen utile de dosimétrie biologique (AIEA, 1986).
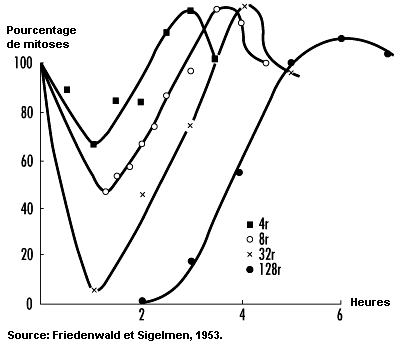
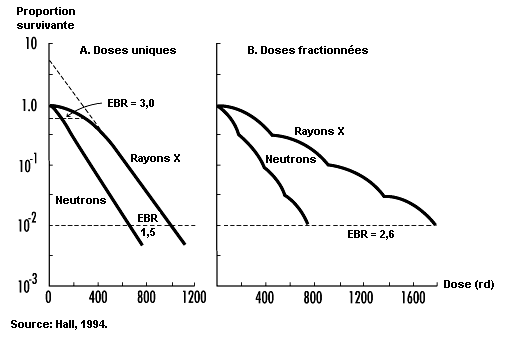
Effets sur la survie des cellules . L’inhibition de la division cellulaire compte parmi les premiers effets observés de l’irradiation. Elle se manifeste rapidement après l’exposition et varie avec la dose tant dans son degré que par sa durée (voir figure 48.5). Même si l’inhibition de la mitose est le plus souvent transitoire, les dommages que les rayonnements ionisants font subir aux gènes et aux chromosomes peuvent tuer les cellules en cours de division, qui représentent une classe très radiosensible (CIPR, 1984). Mesurée en fonction de la capacité de prolifération, la survie des cellules en cours de division tend à décroître de façon exponentielle avec l’augmentation de la dose, 1 à 2 Gy suffisant en général pour réduire de moitié le nombre de cellules survivantes (voir figure 48.6).
Effets sur les tissus . Les cellules matures qui ne sont pas en cours de division sont relativement radiorésistantes, contrairement aux cellules en cours de division, qui sont radiosensibles et peuvent être détruites en nombre suffisant pour causer une atrophie du tissu (voir figure 48.7). La vitesse de ce processus dépend de la dynamique de la population cellulaire dans le tissu en cause. Autrement dit, il est en général beaucoup plus lent dans les organes à régénération cellulaire lente, comme le foie et l’endothélium vasculaire, que dans les organes à régénération cellulaire rapide, comme la moelle osseuse, l’épiderme et la muqueuse intestinale (CIPR, 1984). Il convient de noter en outre que si le volume de tissu irradié est assez petit ou que la dose est accumulée d’une manière assez progressive, la prolifération compensatoire des cellules survivantes peut considérablement réduire la gravité de la lésion.
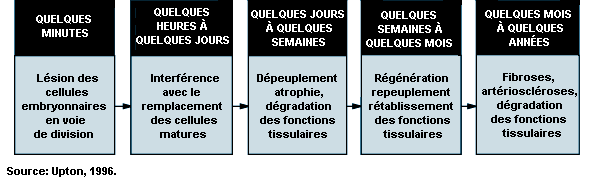
Types d’effets . Les effets des rayonnements ionisants englobent une vaste gamme de réactions très différentes les unes des autres dans leur relation dose-effet, leurs manifestations cliniques, leur succession dans le temps et les pronostics correspondants (Mettler et Upton, 1995). Par commodité, on subdivise souvent les effets en deux grandes catégories: 1) effets héréditaires , ou effets génétiques qui se manifestent chez les descendants des personnes exposées; et 2) effets somatiques , qui se manifestent chez les personnes exposées elles-mêmes. Ces derniers comprennent les effets aigus, qui apparaissent peu après l’irradiation, et les effets à long terme (ou différés), qui peuvent se manifester des mois, des années ou même des décennies plus tard.
Effets aigus . Les effets aigus des rayonnements ionisants résultent surtout de l’appauvrissement en cellules capables de reproduction dans les tissus irradiés (voir figure 48.7) et ne se manifestent qu’en présence de doses assez importantes pour détruire beaucoup de ces cellules (voir par exemple le tableau 48.3). C’est pour cette raison que l’on considère que ces effets sont de nature non stochastique ou déterministe (CIPR, 1984, 1991). Il n’en est pas de même des effets mutagènes et cancérogènes des rayonnements, considérés comme des phénomènes stochastiques résultant d’altérations moléculaires aléatoires de cellules individuelles, dont la fréquence croît en fonction linéaire de la dose, indépendamment de tout seuil (BEIR V, 1990; CIPR, 1991).
|
Organe ou tissu |
Lésion à 5 ans |
Dose seuil (Gy)* |
Zone irradiée (surface) |
|
Peau |
Ulcère, fibrose grave |
55 |
100 cm2 |
|
Muqueuse buccale |
Ulcère, fibrose grave |
60 |
50 cm2 |
|
Œsophage |
Ulcère, rétrécissement |
60 |
75 cm2 |
|
Estomac |
Ulcère, perforation |
45 |
100 cm2 |
|
Intestin grêle |
Ulcère, rétrécissement |
45 |
100 cm2 |
|
Côlon |
Ulcère, rétrécissement |
45 |
100 cm2 |
|
Rectum |
Ulcère, rétrécissement |
55 |
100 cm2 |
|
Glandes salivaires |
Xérostomie |
50 |
50 cm2 |
|
Foie |
Insuffisance hépatique, ascite |
35 |
Organe entier |
|
Rein |
Néphrosclérose |
23 |
Organe entier |
|
Vessie |
Ulcère, spasmes |
60 |
Organe entier |
|
Testicule |
Stérilité permanente |
5-15 |
Organe entier |
|
Ovaire |
Stérilité permanente |
2-3 |
Organe entier |
|
Utérus |
Nécrose, perforation |
>100 |
Organe entier |
|
Vagin |
Ulcère, fistule |
90 |
5 cm2 |
|
Sein (enfant) |
Hypoplasie |
10 |
5 cm2 |
|
Sein (adulte) |
Atrophie, nécrose |
>50 |
Organe entier |
|
Poumon |
Pneumonite, fibrose |
40 |
Lobe |
|
Capillaires |
Télangiectasie, fibrose |
50-60 |
— |
|
Cœur |
Péricardite, pancardite |
40 |
Organe entier |
|
Os (enfant) |
Arrêt de la croissance |
20 |
10 cm2 |
|
Os (adulte) |
Nécrose, fracture |
60 |
10 cm2 |
|
Cartilage (enfant) |
Arrêt de la croissance |
10 |
Organe entier |
|
Cartilage (adulte) |
Nécrose |
60 |
Organe entier |
|
Système nerveux central (cerveau) |
Nécrose |
50 |
Organe entier |
|
Moelle épinière |
Nécrose, section |
50 |
5 cm2 |
|
Œil |
Panophthalmie, hémorragie |
55 |
Organe entier |
|
Cornée |
Kératite |
50 |
Organe entier |
|
Cristallin |
Cataracte |
5 |
Organe entier |
|
Oreille (interne) |
Surdité |
>60 |
Organe entier |
|
Thyroïde |
Hypothyroïdie |
45 |
Organe entier |
|
Surrénale |
Hypocorticisme |
>60 |
Organe entier |
|
Hypophyse |
Hypopituitarisme |
45 |
Organe entier |
|
Muscle (enfant) |
Hypoplasie |
20-30 |
Organe entier |
|
Muscle (adulte) |
Atrophie |
>100 |
Organe entier |
|
Moelle osseuse |
Hypoplasie |
2 |
Organe entier |
|
Moelle osseuse |
Hypoplasie, fibrose |
20 |
Localisée |
|
Ganglion lymphatique |
Atrophie |
33-45 |
— |
|
Vaisseaux lymphatiques |
Sclérose |
50 |
— |
|
Fœtus |
Mort |
2 |
Organe entier |
* Dose provoquant des effets chez 1 à 5% des personnes exposées.
Source: Rubin et Casarett, 1972.
Les lésions aiguës, qui étaient courantes chez les premiers travailleurs exposés aux rayonnements ionisants et les premiers malades soumis à des traitements de radiothérapie, ont pratiquement disparu par suite de l’amélioration des mesures de sécurité et des méthodes de traitement. Néanmoins, la plupart des malades traités par irradiation de nos jours subissent encore certaines lésions dans des tissus sains. De plus, des accidents graves continuent à se produire. En effet, les quelque 285 accidents déclarés (Tchernobyl non compris) survenus dans les centrales nucléaires de différents pays entre 1945 et 1987 ont provoqué l’irradiation de plus de 1 350 personnes, dont 33 ont été mortellement atteintes (Lushbaugh, Fry et Ricks, 1987). A lui seul, l’accident de Tchernobyl a libéré suffisamment de substances radioactives pour nécessiter l’évacuation de dizaines de milliers de personnes et d’animaux de la région environnante. En outre, plus de 200 sapeurs-pompiers et membres d’équipes d’urgence ont été atteints du mal des rayons et 31 en sont morts (Comité scientifique des Nations Unies pour l’étude des effets des rayonnements ionisants (UNSCEAR), 1988). On ne peut prédire avec certitude les effets à long terme des substances radioactives libérées, mais l’estimation des risques d’effets cancérogènes basée sur des modèles de relation dose-effet sans seuil (que nous examinons plus loin) donne à penser que la population de l’hémisphère septentrional pourrait enregistrer, par suite de l’accident, 30 000 décès supplémentaires par cancer au cours des 70 prochaines années, quoique le nombre de cancers supplémentaires enregistré dans chaque pays sera vraisemblablement trop petit pour être décelable sur une base épidémiologique (United States Department of Energy (USDOE), 1987).
Nettement moins catastrophiques, mais beaucoup plus nombreux que les défaillances de centrales nucléaires, les accidents causés par des sources médicales et industrielles de rayons gamma ont également fait des morts et des blessés. C’est ainsi qu’en 1987 la mise à la ferraille non contrôlée d’une source de radiothérapie au césium 137 à Goiânia, au Brésil, a entraîné l’irradiation de dizaines de personnes non informées, dont quatre sont mortes (UNSCEAR, 1993).
Un examen complet des lésions causées par les rayonnements ionisants dépasserait le cadre du présent article. Toutefois, compte tenu de l’intérêt général d’informations sur les réactions aiguës des tissus les plus radiosensibles, nous croyons utile d’en présenter une brève description dans les paragraphes suivants.
Peau . Les cellules de la couche basale de l’épiderme sont particulièrement radiosensibles. Par conséquent, une exposition rapide de la peau à une dose de 6 Sv ou plus provoque un érythème (rougeur) de la zone affectée, qui apparaît en général dans la journée qui suit, dure ordinairement quelques heures, puis est suivi, deux à quatre semaines plus tard, par une ou plusieurs vagues d’un érythème plus profond et plus prolongé, ainsi que par une dépilation (perte de poils ou de cheveux). Si la dose dépasse 10 à 20 Sv, phlyctène, nécrose et ulcération se manifestent dans les deux à quatre semaines, puis sont suivies par une fibrose du derme et du système vasculaire sous-jacent, qui peut mener à l’atrophie et à une deuxième vague d’ulcérations quelques mois ou quelques années plus tard (CIPR, 1984).
Moelle osseuse et organes lymphoïdes . Les lymphocytes sont aussi très radiosensibles: une dose de 2 à 3 Sv reçue rapidement par tout le corps peut en tuer suffisamment en quelques heures pour faire chuter la numération lymphocytaire périphérique et compromettre les réactions immunitaires (UNSCEAR, 1988). Egalement radiosensibles, les cellules hématopoïétiques de la moelle osseuse peuvent diminuer suffisamment en nombre sous l’effet d’une dose comparable pour causer une granulocytopénie et une thrombocytopénie dans les trois à cinq semaines qui suivent. Ces réductions des numérations de granulocytes et de plaquettes peuvent être assez graves après une forte irradiation pour provoquer une hémorragie ou une infection mortelle (voir tableau 48.4).
|
Temps écoulé après l’irradiation |
Forme cérébrale |
Forme gastro- |
Forme hémato- |
Forme pulmonaire |
|
Premier jour |
Nausées |
Nausées |
Nausées |
Nausées |
|
Deuxième semaine |
Nausée |
|||
|
Troisième à sixième semaine |
Faiblesse |
|||
|
Deuxième à huitième mois |
Toux |
Source: UNSCEAR, 1988.
Intestin . Les cellules souches du revêtement épithélial de l’intestin grêle sont extrêmement radiosensibles. Une exposition aiguë à 10 Sv peut en réduire suffisamment le nombre pour dénuder les villosités intestinales en quelques jours (CIPR, 1984; UNSCEAR, 1988). La dénudation d’une importante surface de la muqueuse provoque souvent un syndrome dysentériforme fulminant pouvant rapidement évoluer vers le décès de la victime (voir tableau 48.4).
Gonades . Les spermatozoïdes matures peuvent survivre à de fortes doses (100 Sv) de rayonnements ionisants, mais les spermatogonies sont tellement radiosensibles qu’une dose de 0,15 Sv appliquée rapidement aux deux testicules suffit pour provoquer l’oligospermie et qu’une dose de 2 à 4 Sv peut entraîner une stérilité permanente. Les ovocytes sont aussi fortement radiosensibles: l’exposition rapide des deux ovaires à une dose de 1,5 à 2 Sv peut causer une stérilité temporaire, pouvant devenir permanente si la dose augmente, selon l’âge de la femme au moment de l’exposition (CIPR, 1984).
Voies respiratoires . Les poumons ne sont pas fortement radiosensibles, mais une exposition rapide à une dose de 6 à 10 Sv peut provoquer, un à trois mois plus tard, une pneumonie aiguë dans la zone exposée. Si un important volume de tissu pulmonaire est affecté, la victime peut souffrir d’insuffisance respiratoire dans les semaines suivantes ainsi que de fibrose pulmonaire et de cœur pulmonaire quelques mois ou quelques années plus tard (CIPR, 1984; UNSCEAR, 1988).
Cristallin . Les cellules de l’épithélium antérieur du cristallin, qui continuent à se diviser pendant toute la vie, sont relativement radiosensibles. Par conséquent, une exposition rapide du cristallin à une dose dépassant 1 Sv peut aboutir en quelques mois à la formation d’une opacité polaire postérieure microscopique. De même, une dose de 2 à 3 Sv reçue en une fois dans un court laps de temps ou une dose de 5,5 à 14 Sv accumulée sur une période de quelques mois peut provoquer une grave cataracte (CIPR, 1984).
Autres tissus . Par comparaison aux tissus mentionnés ci-dessus, les autres tissus de l’organisme sont en général nettement moins radiosensibles (voir, par exemple, le tableau 48.4). Toutefois, l’embryon constitue une importante exception à cet égard, comme nous le notons plus loin. Il y a également lieu de signaler que la radiosensibilité d’un tissu augmente s’il est en phase de croissance rapide (CIPR, 1984).
Radiolésions dues à une irradiation totale . L’exposition rapide d’une importante partie du corps à une dose dépassant 1 Gy peut provoquer le syndrome de radioexposition aiguë . Ce syndrome comporte diverses phases: 1) une phase prodromique initiale caractérisée par des symptômes tels que malaises, anorexie, nausées et vomissements; 2) une période de latence; 3) une deuxième phase (principale) de maladie; et enfin 4) soit le rétablissement, soit la mort (voir tableau 48.4). La phase principale de la maladie prend le plus souvent l’une des formes suivantes, selon la localisation prédominante des radiolésions: 1) forme hématologique; 2) forme gastro-intestinale; 3) forme cérébrale; ou 4) forme pulmonaire (voir tableau 48.4).
Radiolésions localisées . Contrairement aux manifestations cliniques, en général rapides et spectaculaires, du syndrome de radioexposition aiguë découlant de l’exposition de tout le corps, la réaction à une irradiation très localisée, produite par une source extérieure ou un radionucléide déposé à l’intérieur de l’organisme, tend à se manifester lentement avec peu de symptômes ou de signes extérieurs, à moins que le volume de tissus irradiés ou que la dose ne soient relativement importants (voir, par exemple, tableau 48.4).
Effets des radionucléides . Certains radionucléides, comme le tritium (3H), le carbone 14 (14C) et le césium 137 (137Cs), tendent à se répartir dans tout l’organisme, produisant une irradiation totale, tandis que d’autres radionucléides se fixent plutôt dans des organes particuliers, provoquant des lésions très localisées. Le radium et le strontium 90 (90Sr), par exemple, se fixent essentiellement dans les os, causant surtout des lésions osseuses, tandis que l’iode radioactif se concentre dans la glande thyroïde, qui est donc la première atteinte (Stannard, 1988; Mettler et Upton, 1995).
Caractéristiques générales . La cancérogénicité des rayonnements ionisants, notée dès le début du siècle à cause de la fréquence du cancer de la peau et de la leucémie chez les pionniers de l’étude des radiations (Upton, 1986), a été largement démontrée depuis par l’existence d’une relation entre la dose et les excès de néoplasmes tous types confondus chez les travailleurs ayant manipulé des peintures luminescentes au radium, les mineurs en roche dure travaillant sous terre, les survivants des bombardements atomiques, les malades soumis à des traitements de radiothérapie et les animaux de laboratoire irradiés à titre expérimental (Upton, 1986; BEIR V, 1990).
Les tumeurs bénignes et malignes induites par irradiation mettent le plus souvent des années sinon des décennies à se développer et ne se distinguent en rien des tumeurs attribuables à d’autres causes. De plus, à peu d’exceptions près, il n’a été possible de les déceler qu’après l’application d’équivalents de dose relativement importants (0,5 Sv) et leur développement variait avec le type de néoplasme ainsi qu’avec l’âge et le sexe des personnes exposées (BEIR V, 1990).
Mécanismes . Les mécanismes moléculaires de la cancérogenèse due aux radiations ne sont pas encore connus dans tous leurs détails. Toutefois, l’observation d’animaux de laboratoire et de cultures de cellules a permis de constater que les rayonnements ionisants ont, selon les conditions expérimentales, des effets initiateurs, des effets promoteurs et des effets sur la progression du processus néoplasique (BEIR V, 1990). Leurs effets cancérogènes semblent également comprendre l’activation d’oncogènes ou encore l’inactivation ou la perte d’antioncogènes dans beaucoup sinon la totalité des cas. De plus, ces effets ressemblent énormément à ceux des agents cancérogènes chimiques en ce qu’ils sont modifiables par des hormones, des variables nutritionnelles et d’autres facteurs modificateurs (BEIR V, 1990). Ils peuvent en outre s’ajouter ou s’opposer à ceux des agents cancérogènes chimiques ou agir en synergie avec eux, selon les composés et les conditions d’exposition (UNSCEAR, 1982, 1986).
Relation dose-effet . Les données existantes ne suffisent ni à décrire sans ambiguïté la relation dose-incidence pour un type quelconque de néoplasme ni à définir le laps de temps, après l’irradiation, pendant lequel le risque de développement d’une tumeur demeure élevé dans une population exposée. Les risques attribuables à une irradiation de faible niveau ne peuvent donc être estimés que par extrapolation, sur la base de modèles comportant des hypothèses au sujet de ces paramètres (BEIR V, 1990). Parmi les différents modèles dose-effet utilisés pour estimer les risques d’une irradiation de faible niveau, celui qui a été jugé le mieux ajusté aux données existantes a la formule suivante:
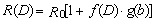
où R0 représente le risque naturel, selon l’âge, de mourir d’un type donné de cancer; D, la dose reçue; f(D) , une fonction de la dose qui est linéaire quadratique dans le cas de la leucémie et linéaire pour les autres types de cancers; et g(b) , une fonction de risque dépendant d’autres paramètres tels que le sexe, l’âge au moment de l’exposition et le temps écoulé depuis celle-ci (BEIR V, 1990).
De tels modèles sans seuil ont été appliqués aux données épidémiologiques des survivants de Nagasaki et d’Hiroshima et d’autres populations irradiées pour calculer le risque d’apparition de différentes formes de cancers radio-induits (voir, par exemple, tableau 48.5). Il faut cependant interpréter ces estimations avec prudence si l’on cherche à prédire le risque de cancer attribuable à de faibles doses ou à des doses accumulées pendant des semaines, des mois ou des années, parce que les expériences effectuées sur des animaux de laboratoire ont établi que le pouvoir cancérogène des rayons X et gamma peut diminuer d’un ordre de grandeur lorsque l’exposition est répartie sur une longue période. En fait, comme d’autres sources l’expliquent (BEIR V, 1990), les données disponibles n’excluent pas la possibilité de l’existence d’un seuil d’équivalent de dose de l’ordre du millisievert (mSv), en deçà duquel le pouvoir cancérogène d’un rayonnement serait nul.
|
Type ou site du cancer |
Excès de décès par cancer pour 100 000 habitants |
|
|
Nombre |
Pourcentage* |
|
|
Estomac |
110 |
18 |
|
Poumon |
85 |
3 |
|
Côlon |
85 |
5 |
|
Leucémie (sauf leucémie lymphoïde chronique (LLC)) |
|
|
|
Vessie |
30 |
5 |
|
Œsophage |
30 |
10 |
|
Sein |
20 |
1 |
|
Foie |
15 |
8 |
|
Gonades |
10 |
2 |
|
Thyroïde |
8 |
8 |
|
Ostéosarcome |
5 |
5 |
|
Peau |
2 |
2 |
|
Autres |
50 |
1 |
|
Total |
500 |
2 |
* Pourcentage d’augmentation par rapport au taux de mortalité «naturel» d’une population non irradiée.
Source: CIPR, 1991.
Il y a également lieu de noter que les tableaux présentés reposent sur les moyennes d’une population et ne s’appliquent donc pas nécessairement à un individu donné. Autrement dit, la prédisposition à certains types de cancer (comme ceux de la thyroïde et du sein) est sensiblement plus élevée chez les enfants que chez les adultes. De plus, elle augmente chez les personnes atteintes de certains troubles héréditaires, comme le rétinoblastome et la carcinome nævoïde basocellulaire (UNSCEAR, 1988, 1994; BEIR V, 1990). En dépit de ces différences de susceptibilité, certains experts ont proposé d’utiliser ces estimations fondées sur les moyennes dans des affaires d’indemnisation, comme base de calcul de la probabilité qu’un cancer chez une personne irradiée ait été causé par l’irradiation en question (NIH, 1985).
Risque des faibles doses . Les études épidémiologiques entreprises jusqu’ici pour vérifier si le risque de cancer attribuable à une exposition de faible niveau varie avec la dose selon le modèle présenté ci-dessus n’ont pas été concluantes. Les populations des régions où le rayonnement naturel est élevé ne manifestent aucune augmentation des taux de cancer que l’on puisse lui attribuer avec certitude (BEIR V, 1990; UNSCEAR, 1994). En fait, quelques études ont même suggéré l’existence d’une relation inverse entre le niveau du rayonnement naturel et les taux de cancer, relation que certains observateurs ont interprétée comme preuve des effets bénéfiques (ou des propriétés de l’effet ormesis) de l’irradiation de faible intensité par suite des réactions adaptatives de certains systèmes cellulaires (UNSCEAR, 1994). La relation inverse est cependant d’une validité douteuse, puisqu’elle n’a pas persisté lorsqu’on a tenu compte des effets des variables de confusion (BEIR V, 1990). De même, chez les travailleurs exposés aux rayonnements — sauf en ce qui concerne quelques cohortes de mineurs en roche dure travaillant sous terre (BEIR V, 1994; Lubin et coll., 1994) —, on ne signale pas aujourd’hui d’excédent de cancer, à part la leucémie (UNSCEAR, 1994), grâce aux mesures de radioprotection prises. De plus, les taux de leucémie chez ces travailleurs concordent avec les estimations présentées ci-dessus (CIRC, 1994). Bref, les données dont on dispose à l’heure actuelle sont compatibles avec ces estimations (voir tableau 48.5), selon lesquelles moins de 3% des cancers de l’ensemble de la population sont attribuables au rayonnement naturel (BEIR V, 1990; CIRC, 1994), quoiqu’un pourcentage pouvant atteindre 10% des cancers du poumon puisse être imputable au radon présent dans les locaux habités (BEIR V, 1990; Lubin et coll., 1994).
On a pu constater que les retombées hautement radioactives d’un essai nucléaire réalisé dans les îles de Bikini en 1954 ont causé une augmentation liée à la dose de la fréquence des cancers de la thyroïde chez des habitants des îles Marshall qui avaient subi une forte irradiation de la thyroïde lorsqu’ils étaient enfants (Robbins et Adams, 1989). De même, on a signalé que les enfants des régions de la Biélorussie et de l’Ukraine contaminées par l’accident de Tchernobyl présentaient une incidence accrue de cancer de la thyroïde (Prisyazhiuk et coll., 1991; Kasakov, Demidchik et Astakhova, 1992). Ces résultats cependant divergent de ceux obtenus dans le cadre du Programme international sur les effets de l’accident de Tchernobyl sur la santé (International Programme on the Health Effects of the Chernobyl Accident (IPHECA)), selon lequel aucun excès de nodules thyroïdiens bénins ou malins n’était observé chez les enfants vivant dans les zones fortement contaminées situées aux alentours de Tchernobyl (Mettler et coll., 1992). La raison de cette divergence reste à élucider et l’hypothèse selon laquelle l’excédent de cancers signalé serait seulement imputable à une surveillance renforcée doit encore être examinée. Il y a lieu de noter, à cet égard, que chez les enfants du sud-ouest de l’Utah et du Nevada qui avaient été exposés aux retombées des essais nucléaires menés dans le Nevada dans les années cinquante, il y avait une fréquence accrue de tous les genres de cancers de la thyroïde (Kerber et coll., 1993) et que la prévalence de la leucémie aiguë semble avoir été élevée parmi les enfants de ces régions décédés entre 1952 et 1957, période de plus forte exposition aux retombées (Stevens et coll., 1990).
Certains auteurs ont également suggéré que les excès de leucémie observés parmi les enfants vivant au voisinage des centrales nucléaires au Royaume-Uni pourraient être dus aux rejets radioactifs émis par ces centrales. Pourtant, on a estimé que les rejets n’ont ajouté que moins de 2% à la dose totale de rayonnement à laquelle ces enfants ont été exposés, ce qui porte à croire que d’autres explications sont plus probables (Doll, Evans et Darby, 1994). Il est possible que les excès de leucémie observés aient fait l’objet d’une recherche étiologique insuffisante: c’est ce que suggère l’existence d’excès comparables de leucémie infantile à des endroits au Royaume-Uni qui n’ont aucune centrale nucléaire, mais qui ont récemment connu, comme les sites de telles centrales, d’importants accroissements démographiques (Kinlen, 1988; Doll, Evans et Darby, 1994). Une étude cas-témoins (Gardner et coll., 1990) a abouti à une autre hypothèse, celle que les leucémies en question puissent découler de l’exposition professionnelle des pères des enfants en cause. Toutefois, cette hypothèse est en général rejetée pour les raisons que nous examinons dans la section suivante.
Quoique bien documentés pour d’autres organismes vivants, les effets héréditaires de l’irradiation n’ont jamais été observés chez les humains. Ainsi, une étude intensive de plus de 76 000 enfants de survivants japonais des bombardements atomiques, qui s’est étendue sur une quarantaine d’années, n’a révélé aucun effet héréditaire des rayonnements ionisants sur cette population, tels que grossesses à issue défavorable, décès chez les nouveau-nés, tumeurs malignes, translocations chromosomiques équilibrées, aneuploïdie des chromosomes sexuels, altérations des phénotypes de protéines sériques ou érythrocytaires, changements du sexe ratio ou troubles de la croissance et du développement (Neel et coll., 1990). Par conséquent, l’estimation des risques d’effets héréditaires des rayonnements dépend dans une grande mesure de l’extrapolation des conclusions tirées de l’observation de souris et d’autres animaux de laboratoire (BEIR V, 1990; UNSCEAR, 1993).
D’après les données expérimentales et épidémiologiques disponibles, on a déduit que la dose nécessaire pour doubler le taux de mutations héréditaires dans les cellules reproductrices humaines est d’au moins 1,0 Sv (BEIR V, 1990; UNSCEAR, 1993). On estime, sur cette base, que moins de 1% de l’ensemble des maladies humaines d’origine génétique sont attribuables au rayonnement naturel (voir tableau 48.6).
|
Type de trouble |
Prévalence naturelle (par million de naissances vivantes) |
Contribution des sources naturelles de rayonnement1 (par million de naissances vivantes)2 |
|
|
Première génération |
Générations d’équilibre3 |
||
|
Autosomique dominant |
180 000 |
20-100 |
300 |
|
Lié au sexe |
400 |
<1 |
<15 |
|
Récessif |
2 500 |
<1 |
Augmentation très lente |
|
Chromosomique |
4 400 |
<20 |
Augmentation très lente |
|
Malformations congénitales |
20 000- 30 000 |
30 |
30-300 |
|
Autres troubles à étiologie complexe |
|||
|
Cardiopathie |
600 000 |
Non estimé4 |
Non estimé4 |
|
Cancer |
300 000 |
Non estimé4 |
Non estimé4 |
|
Autres troubles définis |
300 000 |
Non estimé4 |
Non estimé4 |
1 Equivalent de ~1mSv par an, ou ~30 mSv par génération (30 ans). 2 Valeurs arrondies. 3 Après des centaines de générations, l’addition de mutations radio-induites défavorables est, en définitive, compensée par leur perte dans la population, ce qui aboutit à une forme d’«équilibre» génétique. 4 On ne dispose pas d’estimations quantitatives des risques à cause de l’incertitude liée à la composante mutationnelle des maladies en cause.
Source: d’après Committee on the Biological Effects of Ionizing Radiations (BEIR V), 1990.
Comme nous l’avons mentionné plus haut, les résultats d’une étude cas-témoins (Gardner et coll., 1990) avaient permis d’avancer l’hypothèse selon laquelle le surcroît de fréquence des leucémies et des lymphomes non hodgkiniens chez les jeunes du village de Seascale résultait des effets oncogènes héréditaires de l’exposition professionnelle aux rayonnements des pères de ces enfants qui avaient travaillé à l’installation nucléaire de Sellafield. Toutefois, cette hypothèse s’est heurtée à de nombreux arguments contraires, notamment:
On peut donc dire, dans l’ensemble, que les données disponibles ne confirment pas l’hypothèse de l’irradiation des gonades paternelles (Doll, Evans et Darby, 1994; Little, Charles et Wakeford, 1995).
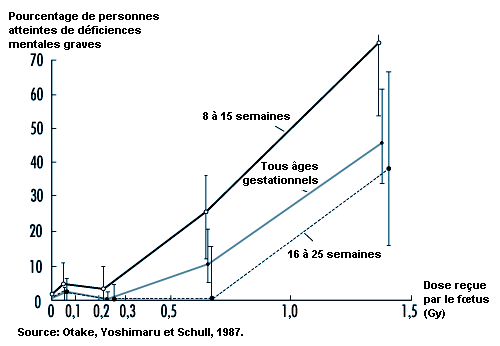
La radiosensibilité est assez élevée pendant toute la vie prénatale, mais les effets d’une dose donnée varient considérablement avec la phase de développement de l’embryon ou du fœtus au moment de l’exposition (UNSCEAR, 1986). C’est avant l’implantation que l’embryon court les plus grands risques d’être tué par l’irradiation, tandis qu’il est plus susceptible de subir des malformations et d’autres troubles du développement durant les phases critiques de l’organogenèse (voir tableau 48.7). Ce dernier fait est illustré par l’augmentation, liée à la dose, de la fréquence des déficiences mentales graves (voir figure 48.8) et par la baisse, également liée à la dose, des scores de quotient intellectuel des survivants des bombardements atomiques qui avaient été exposés entre huit et quinze semaines (et, dans une moindre mesure, entre seize et vingt-cinq semaines) (UNSCEAR, 1986, 1993).
|
Cerveau |
||
|
Anencéphalie |
Porencéphalie |
Microcéphalie* |
|
Encéphalocèle |
Syndrome de Down* |
Medulla réduite |
|
Atrophie cérébrale |
Retard mental* |
Neuroblastome |
|
Aqueduc étroit |
Hydrocéphalie* |
Dilatation des ventricules* |
|
Anomalies de la moelle épinière* |
Anomalies des nerfs crâniens |
|
|
Yeux |
||
|
Anophthalmie |
Microphthalmie* |
Microcornée* |
|
Colobome* |
Déformation de l’iris |
Absence du cristallin |
|
Absence de la rétine |
Paupières ouvertes |
Strabisme* |
|
Nystagmus* |
Rétinoblastome |
Hypermétropie |
|
Glaucome |
Cataracte* |
Cécité |
|
Chorio-rétinite* |
Albinisme partiel |
Ankyloblépharon |
|
Squelette |
||
|
Arrêt général de la croissance |
Crâne de taille réduite |
Malformations du crâne* |
|
Défauts de l’ossification de la tête* |
Crâne bombé |
Tête étroite |
|
Bulles crâniennes |
Bec-de-lièvre* |
Thorax en entonnoir |
|
Luxation de la hanche |
Spina bifida |
Déformation du coccyx |
|
Déformation des pieds |
Pied bot* |
Anomalies des doigts* |
|
Valgus calcanéen |
Odontogenesis imperfecta* |
Exostose tibiale |
|
Amélogenèse* |
Nécrose sclérotomienne |
|
|
Autres |
||
|
Situs inversus |
Hydronéphrose |
Urétéro-hydrose |
|
Hydrocèle |
Absence d’un rein |
Anomalies gonadiques* |
|
Cardiopathies congénitales |
Malformations de la face |
Maladies de l’hypophyse |
|
Malformations des oreilles |
Troubles moteurs |
Nécrose des dermatomes |
|
Nécrose des myotomes |
Anomalies de la pigmentation cutanée |
|
* Ces anomalies ont été observées chez des humains exposés avant la naissance à d’importantes doses de rayonnement et ont, par conséquent, été provisoirement attribuées à l’irradiation.
Source: Brill et Forgotson, 1964.
La sensibilité aux effets cancérogènes des rayonnements semble aussi assez élevée pendant toute la période prénatale, si l’on en juge d’après l’association entre les cancers infantiles (y compris la leucémie) et l’exposition prénatale aux rayons X utilisés à des fins diagnostiques dans des études cas-témoins (BEIR V, 1990). Les résultats de ces études impliquent que l’irradiation prénatale pourrait multiplier le risque de leucémie et d’autres cancers infantiles par un facteur de 40 par Sv (UNSCEAR, 1986; BEIR V, 1990), ce qui est bien plus important que l’accroissement imputable à l’exposition postnatale (UNSCEAR, 1986; BEIR V, 1990). Si, paradoxalement, on n’a noté aucun excès de cancer infantile chez les survivants des bombardements atomiques qui avaient été irradiés avant leur naissance (Yoshimoto et coll., 1990), le nombre de ces survivants était trop faible pour que l’on puisse exclure un tel effet.
Les effets nocifs des rayonnements ionisants sur la santé humaine varient considérablement; ils vont de lésions évoluant vers un décès rapide à des effets non immédiats tels que cancers, malformations congénitales et troubles héréditaires qui pourront apparaître des mois, des années, voire des décennies plus tard. La nature, la fréquence et la gravité de ces effets dépendent de la qualité du rayonnement en cause ainsi que de la dose et des conditions d’exposition. La plupart de ces effets apparaissent après une irradiation d’un niveau assez élevé et ne se manifestent donc que chez des victimes d’accidents, des malades ayant subi des traitements de radiothérapie et d’autres personnes fortement irradiées. Par contre, on considère que la fréquence des effets génotoxiques et cancérogènes des rayonnements ionisants augmente en proportion directe de la dose sans qu’il semble exister de seuil. Par conséquent, même si l’on ne peut pas totalement exclure la possibilité qu’un tel seuil existe, on part de l’hypothèse que la fréquence des effets croît avec la dose pour tous les niveaux d’exposition. Pour la plupart des effets des rayonnements, la sensibilité des cellules exposées varie en fonction directe de leur taux de prolifération et en fonction inverse de leur degré de différenciation, l’embryon et les enfants en cours de développement étant particulièrement vulnérables.
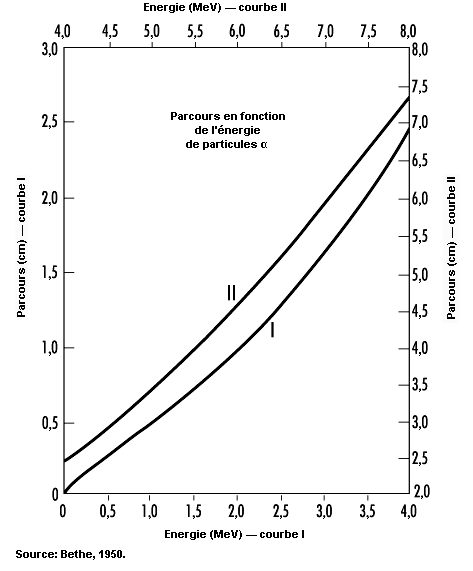
Une particule alpha est un ensemble étroitement lié formé de deux protons et de deux neutrons. Elle est identique à un noyau d’hélium 4 (4He). De fait, après avoir perdu la plus grande partie de son énergie cinétique, cette particule capturera en définitive deux électrons pour devenir un atome d’hélium.
Les radionucléides émetteurs alpha ont en général des noyaux relativement lourds. Presque tous ont un numéro atomique supérieur ou égal à celui du plomb (82Pb). Lorsqu’un noyau se désintègre en émettant une particule alpha, tant son numéro atomique (nombre de protons) que son nombre de neutrons baissent de deux unités, tandis que son nombre de masse diminue de quatre. Par exemple, la désintégration alpha de l’uranium 238 (238U), qui produit du thorium 234 (234Th), est représentée par la formule:
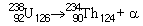
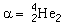
L’indice de gauche en haut est le nombre de masse atomique (nombre de protons + nombre de neutrons), l’indice de gauche en bas étant le numéro atomique (nombre de protons) et l’indice de droite, le nombre de neutrons.
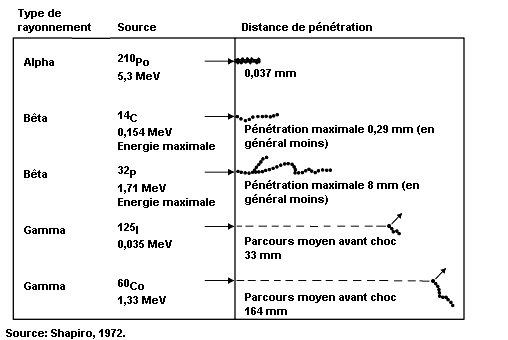
Les émetteurs alpha les plus courants émettent des particules dont l’énergie cinétique se situe entre 4 et 5,5 MeV et qui, dans l’air, ont un parcours ne dépassant pas 5 cm (voir figure 48.9). Pour pénétrer l’épiderme (couche protectrice de la peau, épaisse de 0,07 mm), une particule alpha doit posséder une énergie minimale de 7,5 MeV. Les émetteurs alpha ne présentent pas en général de risques par irradiation externe; ils ne constituent un danger que s’ils sont absorbés par l’organisme. Comme leur parcours est relativement court, leur transfert linéique d’énergie (TLE) est élevé, de même que leur facteur de pondération wR, dont la valeur caractéristique est de 20.
Une particule bêta consiste en un électron ou un positon très énergétique (le positon est l’antiparticule de l’électron. Il a la même masse et la plupart des autres propriétés de l’électron, mais sa charge, exactement égale à celle de l’électron, est cependant de polarité opposée, c’est-à-dire positive). Les radionucléides émetteurs bêta peuvent avoir un numéro atomique faible ou élevé.
Les radionucléides ayant un excédent de protons par rapport à des nucléides stables ayant à peu près le même nombre de masse peuvent se désintégrer si un proton du noyau se transforme en neutron. Lorsque cela se produit, le noyau émet un positon ainsi qu’une particule extrêmement légère et à très faible interaction appelée neutrino (le neutrino et son antiparticule ne présentent pas d’intérêt dans le domaine de la radioprotection). Une fois qu’il a perdu la plus grande partie de son énergie cinétique, le positon finit par heurter un électron, provoquant l’annihilation des deux particules. Le rayonnement d’annihilation consiste presque toujours en deux photons de 0,511 MeV émis dans des directions opposées à 180 degrés. La formule suivante illustre une désintégration caractéristique par émission de positons:
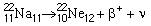
le positon étant représenté par β+ et le neutrino par ν. Il convient de noter que le nucléide résultant a le même nombre de masse atomique que le nucléide père, un numéro atomique (nombre de protons) inférieur d’une unité et un nombre de neutrons supérieur d’une unité.
La capture d’électrons est un phénomène concurrent. Dans la désintégration par capture d’électrons, le noyau absorbe un électron orbital et émet un neutrino. La formule suivante illustre une désintégration caractéristique de ce genre:
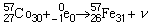
La capture d’électrons est toujours possible quand le noyau résultant a une énergie totale inférieure à celle du noyau initial. Par contre, la désintégration par émission de positons ne peut se produire que si l’énergie totale de l’atome initial dépasse celle de l’atome résultant de plus de 1,02 MeV (deux fois l’énergie correspondant à la masse au repos du positon).
Comme les deux formes précédentes, la désintégration par émission de négaton (β–) se produit dans le cas de noyaux ayant un excédent de neutrons par rapport à des noyaux stables d’environ le même nombre de masse. Dans ce cas, le noyau émet un négaton (électron énergétique) et un antineutrino. La formule suivante illustre une désintégration de ce genre:
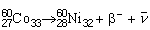
le négaton étant représenté par β– et l’antineutrino par  . Dans ce cas, le noyau résultant acquiert un neutron en perdant un proton, une fois de plus sans changer de nombre de masse.
. Dans ce cas, le noyau résultant acquiert un neutron en perdant un proton, une fois de plus sans changer de nombre de masse.
Comme la désintégration alpha est une réaction à deux particules, les particules alpha émises ont une énergie cinétique de valeur déterminée. Par contre, la radioactivité bêta faisant intervenir trois particules, l’énergie des particules bêta varie selon une distribution continue. L’énergie maximale de cette distribution dépend du radionucléide en cause, l’énergie bêta moyenne correspondant approximativement à un tiers de l’énergie maximale (voir figure 48.10).
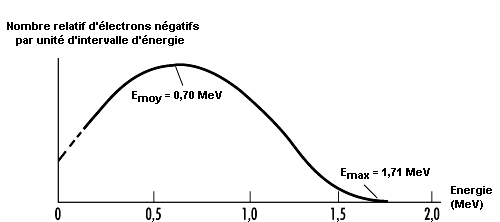
Les énergies maximales bêta caractéristiques se situent entre 18,6 keV dans le cas du tritium (3H) et 1,71 MeV dans le cas du phosphore 32 (32P).
Dans l’air, les particules bêta ont un parcours d’environ 3,65 m par MeV d’énergie cinétique. Elles doivent avoir une énergie minimale de 70 keV pour pénétrer l’épiderme. Les particules bêta ont un faible TLE.
Le rayonnement gamma est une onde électromagnétique émise par un noyau, siège d’une transition d’un niveau d’énergie supérieur à un niveau d’énergie inférieur. La transition ne modifie pas le nombre de protons et de neutrons du noyau. Ce dernier peut se retrouver à un niveau d’énergie supérieur par suite d’une désintégration alpha ou bêta antérieure. Autrement dit, les rayons gamma sont souvent émis immédiatement après des désintégrations alpha ou bêta. Le rayonnement gamma peut également résulter de la capture de neutrons ou de la diffusion inélastique de particules subatomiques par un noyau. C’est dans le rayonnement cosmique que l’on a pu déceler les rayons gamma les plus énergétiques.
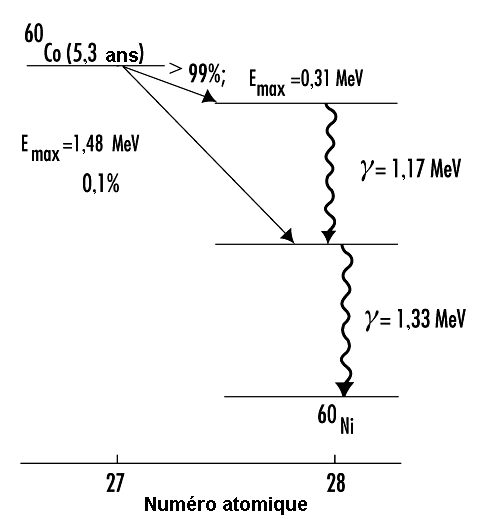
La figure 48.11 présente le schéma de désintégration du cobalt 60 (60Co). La figure montre une cascade de rayons gamma émis dans le nickel 60 (60Ni) avec une énergie de 1,17 et 1,33 MeV, après la désintégration bêta du60Co.
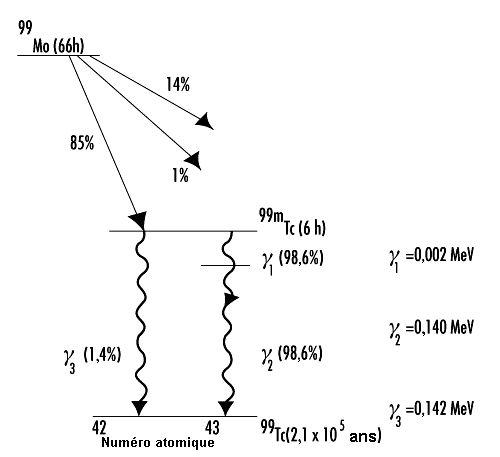
La figure 48.12 présente le schéma de désintégration du molybdène 99 (99Mo). Il y a lieu de noter que le technétium 99 (99Tc) résultant passe par un état excité d’une durée exceptionnellement longue (t½ = 6 h). Un noyau excité de ce genre est appelé isomère . La plupart des états nucléaires excités ont une période radioactive comprise entre quelques picosecondes (ps) et 1 microseconde (µs).
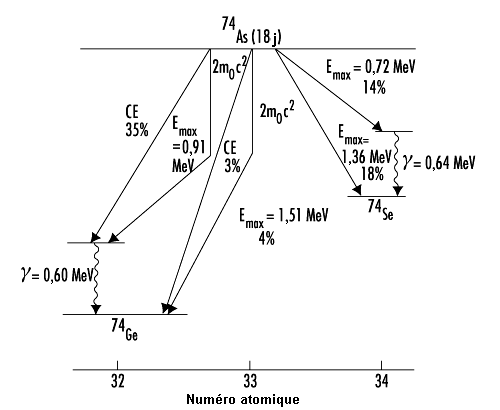
La figure 48.13 présente le schéma de désintégration de l’arsenic 74 (74As). Elle montre que certains radionucléides se désintègrent de plusieurs façons.
Tandis que les particules alpha et bêta ont un parcours défini dans la matière, le rayonnement gamma subit une atténuation exponentielle en traversant la matière (compte non tenu de l’accumulation due à la diffusion). Si on peut négliger cette dernière, l’atténuation du rayonnement gamma est donnée par la formule:
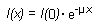
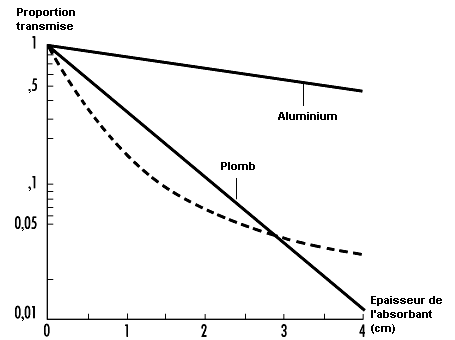
I(x) étant l’intensité du rayonnement gamma en fonction de la distance x franchie dans la matière et µ le coefficient d’atténuation massique. Ce coefficient dépend de l’énergie du rayonnement gamma et de la matière avec laquelle il interagit. Des valeurs caractéristiques de ces coefficients figurent dans beaucoup des ouvrages cités dans les références bibliographiques. La figure 48.14 montre l’absorption du rayonnement gamma dans la matière dans de bonnes conditions de géométrie (permettant de négliger l’accumulation).
L’accumulation se produit lorsqu’un large faisceau de rayons gamma interagit avec la matière. L’intensité du rayonnement mesurée à certains points est supérieure à la valeur attendue d’une «bonne géométrie» (faisceau étroit) parce que des rayons diffusés des côtés du faisceau direct atteignent l’appareil de mesure. Le degré d’accumulation dépend de la géométrie du faisceau, de la matière traversée et de l’énergie des rayons gamma.
La conversion interne entre en concurrence avec l’émission gamma lorsqu’un noyau passe d’un certain niveau d’énergie à un niveau plus bas. En cas de conversion interne, l’émission par le noyau d’un rayonnement gamma est remplacée par l’éjection d’un électron des orbites internes. Cet électron est directement ionisant. Tandis que les électrons des orbites externes passent à des niveaux d’énergie inférieurs pour remplir le vide laissé par l’électron éjecté, l’atome émet des rayons X. La probabilité de la conversion interne par rapport à celle de l’émission d’un rayonnement gamma augmente avec le numéro atomique.
Les rayons X sont des ondes électromagnétiques. A ce titre, ils ressemblent aux rayons gamma, la différence entre les deux résidant dans l’origine du rayonnement. Les rayons gamma partent du noyau de l’atome, tandis que les rayons X résultent de l’interaction des électrons. Même si les rayons X possèdent souvent moins d’énergie que les rayons gamma, ce critère ne permet pas vraiment de les différencier. Il est en effet possible de produire des rayons X d’énergie bien plus élevée que les rayons gamma qui résultent d’une désintégration radioactive.
La conversion interne, abordée plus haut, est l’un des moyens de produire des rayons X. Dans ce cas, ces rayons ont une énergie de valeur déterminée correspondant à la différence entre les niveaux d’énergie entre lesquels passent les électrons orbitaux.
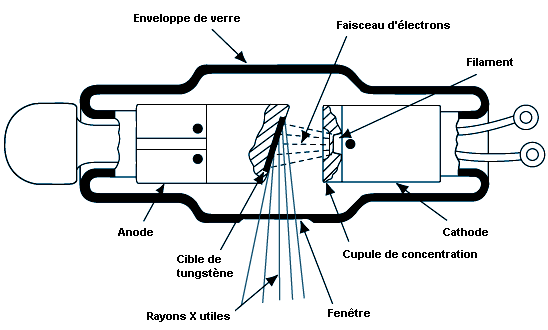
Les particules chargées émettent un rayonnement électromagnétique chaque fois qu’elles sont accélérées ou décélérées, l’intensité du rayonnement émis étant inversement proportionnelle à la quatrième puissance de la masse de la particule. Par conséquent, toutes choses égales, les électrons émettent beaucoup plus de rayons X que les particules plus lourdes, comme les protons. On produit donc les rayons X en accélérant des électrons au moyen d’une différence de potentiel électrique de plusieurs milliers ou même millions de volts. Les électrons sont ensuite rapidement décélérés dans un matériau dense pouvant résister à des températures élevées, comme le tungstène (W).
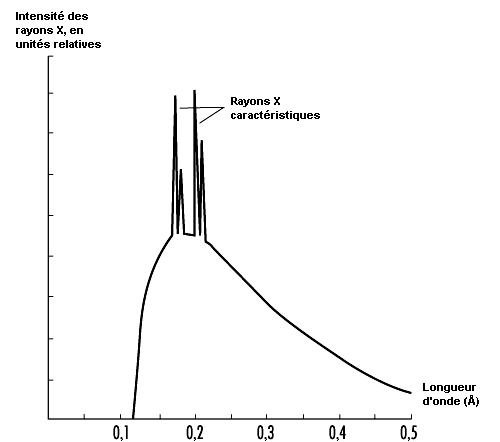
L’énergie des rayons X émis par un tel système forme un spectre continu allant d’environ zéro à l’énergie cinétique maximale que possèdent les électrons avant leur décélération. Souvent, des rayons X à niveaux d’énergie discrets se superposent à ce spectre. Ils sont produits lorsque les électrons incidents ionisent la cible. Tandis que d’autres électrons orbitaux vont remplir les vides laissés par l’ionisation, ils émettent des rayons X à des niveaux discrets d’énergie, de la même façon que dans le processus de conversion interne. Ces rayons X sont dits caractéristiques parce qu’ils définissent de façon unique la matière de la cible (anode ou anticathode). La figure 48.15 présente un spectre caractéristique de rayons X et la figure 48.16 le schéma d’un tube à rayons X.
Les rayons X agissent sur la matière de la même façon que les rayons gamma, sauf qu’une simple équation exponentielle ne suffit pas pour décrire correctement l’atténuation de rayons X ayant un spectre d’énergie continu (voir figure 48.14). Toutefois, comme les rayons X de faible énergie s’affaiblissent plus rapidement que les rayons de haute énergie, tandis que le faisceau traverse la matière, l’atténuation après un certain parcours se rapproche d’une fonction exponentielle.
En général, l’émission de neutrons n’est pas le résultat direct d’une désintégration radioactive naturelle. Les neutrons sont plutôt le produit de réactions nucléaires. Les réacteurs nucléaires produisent beaucoup de neutrons, mais on en obtient également dans les accélérateurs de particules et en utilisant des sources spéciales de neutrons appelées sources (α, n).
Les réacteurs nucléaires produisent des neutrons par fission des noyaux d’uranium (U) du combustible. En fait, la production des neutrons est essentielle au maintien de la réaction de fission.
Les accélérateurs de particules produisent des neutrons en accélérant des particules chargées, comme des protons ou des électrons, puis en les utilisant, une fois qu’elles ont acquis une haute énergie, pour bombarder les noyaux stables d’une cible. Les neutrons ne sont que l’un des types de particules résultant de telles réactions nucléaires. Ainsi, en accélérant des ions de deutérium pour bombarder une cible de béryllium dans un cyclotron, on obtient des neutrons selon la réaction suivante:
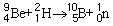
Des émetteurs alpha mélangés à du béryllium peuvent être employés comme sources portables de neutrons, ou sources (α, n), qui agissent selon la réaction:
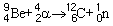
On peut utiliser, comme sources de particules alpha, des isotopes tels que le polonium 210 (210Po), le plutonium 239 (239Pu) et l’américium 241 (241Am).
Les neutrons sont en général classés selon leur énergie, comme le montre le tableau 48.8. Ce classement en quelque sorte arbitraire peut varier avec la situation considérée.
|
Type |
Plage d’énergie |
|
Lent ou thermique |
0-0,1 keV |
|
Intermédiaire |
0,1-20 keV |
|
Rapide |
20 keV-10 MeV |
|
Haute énergie |
>10 MeV |
Il existe plusieurs modes d’interaction des neutrons avec la matière, mais les deux principaux qui nous intéressent, à des fins de radioprotection, sont la diffusion élastique et la capture de neutrons.
La diffusion élastique ramène les neutrons à haute énergie à leur niveau thermique. Interagissant principalement par diffusion élastique, ces neutrons ne causent généralement ni fission ni radioactivité par capture neutronique. Ces interactions sont plutôt produites par les neutrons dits thermiques.
La diffusion élastique résulte de l’interaction d’un neutron avec un noyau, le premier étant dévié de sa trajectoire après avoir cédé une partie de son énergie cinétique au second. Ainsi excité, le noyau libère peu après cette énergie sous forme d’un rayonnement gamma.
Lorsque le neutron atteint finalement son niveau d’énergie thermique (ainsi appelé parce que le neutron se trouve alors en équilibre thermique avec son environnement), il est facilement capturé par la plupart des noyaux. Etant électriquement neutre, le neutron n’est pas repoussé par un noyau positif, comme le serait un proton. Lorsqu’un neutron thermique s’approche assez d’un noyau pour subir l’interaction forte, c’est-à-dire à quelques femtomètres (1 fm = 10–15 mètre), il est capturé par le noyau. Il en résulte un noyau radioactif qui émet un photon ou une autre particule ou, dans le cas d’un noyau fissile comme l’uranium235U ou le plutonium239Pu, se subdivise en deux noyaux plus petits en libérant plus de neutrons.
Conformément aux lois de la cinématique, les neutrons atteignent plus rapidement leur niveau d’énergie thermique si le milieu de diffusion élastique comprend un grand nombre de noyaux légers. Un neutron qui rebondit sur un noyau léger cède une bien plus grande part de son énergie cinétique que s’il rebondissait sur un noyau lourd. C’est pour cette raison que l’eau et les autres substances hydrogénées sont les plus efficaces pour ralentir les neutrons.
Un faisceau monoénergétique de neutrons subit une atténuation exponentielle en traversant la matière, selon une équation semblable à celle que nous avons donnée plus haut pour les photons. La probabilité d’interaction entre un neutron et un noyau donné est exprimée par une grandeur appelée section efficace . La section efficace se mesure en unités de surface, l’unité spéciale adoptée en radioprotection étant le barn (b), ainsi défini:
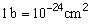
Il est extrêmement difficile de produire des neutrons sans qu’ils soient accompagnés de rayons X et gamma. On peut en fait supposer, d’une manière générale, que la présence de neutrons implique la présence de photons à haute énergie.
Les radionucléides naturels sont présents dans la nature parce que leur période radioactive est comparable à l’âge de la Terre. Le tableau 48.9 énumère les plus importants.
|
Radio-isotope |
Période (109 ans) |
Teneur isotopique (%) |
|
238 U |
4,47 |
99,3 |
|
232 Th |
14,0 |
100 |
|
235 U |
0,704 |
0,720 |
|
40 K |
1,25 |
0,0117 |
|
87 Rb |
48,9 |
27,9 |
Les isotopes de l’uranium et du thorium figurent en tête d’une longue chaîne de descendants radioactifs qui, de ce fait, sont également présents dans la nature. Les parties A à C de la figure 48.17 présentent les schémas de désintégration du thorium232Th, de l’uranium238U et de l’uranium235U. Comme la désintégration alpha est courante aux numéros atomiques supérieurs à 205 et que le nombre de masse d’une particule alpha est de 4, il existe quatre chaînes distinctes de désintégration pour les noyaux lourds. L’une d’elles (partie D de la figure 48.17), celle du neptunium 237 (237Np), n’existe pas dans la nature parce qu’elle ne comporte aucun radionucléide «naturel», c’est-à-dire dont la période radioactive est comparable à l’âge de la Terre.
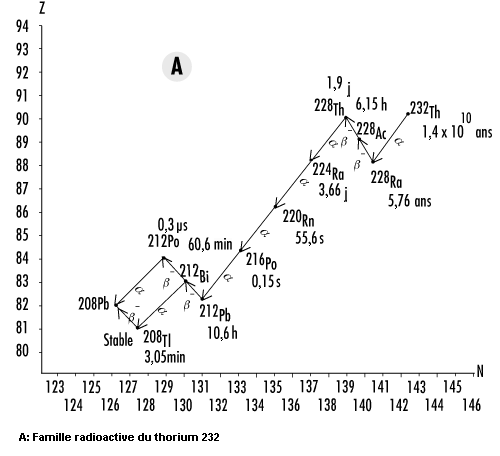
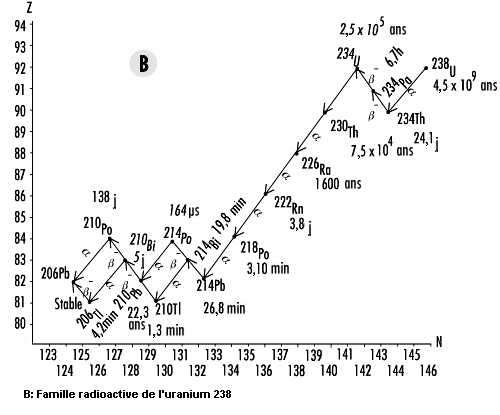
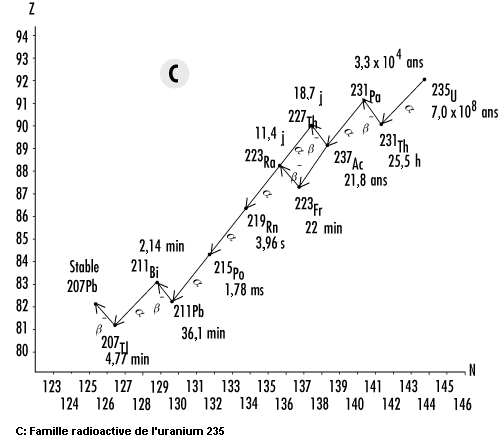
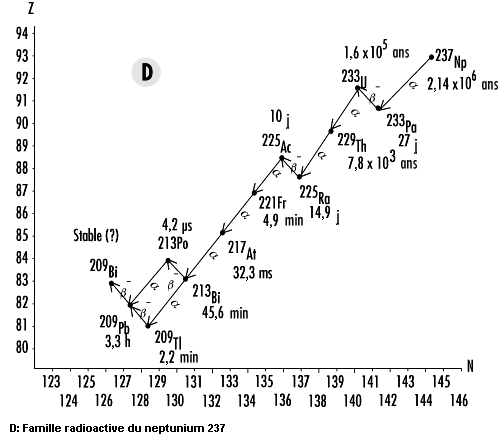
Il y a lieu de noter que les isotopes du radon sont présents dans les quatre chaînes (219Rn,220Rn et222Rn). Comme le radon est un gaz, il a la possibilité, une fois produit, de se libérer de la matrice dans laquelle il s’est formé pour rejoindre l’atmosphère. Cependant, la période du radon 219 est beaucoup trop courte pour que des quantités importantes puissent s’accumuler dans des endroits habités. De même, la période relativement courte du radon 220 fait que l’on s’en préoccupe moins que du radon 222 comme risque pour la santé.
Outre le radon, les radionucléides naturels externes soumettent l’être humain en moyenne à une dose efficace annuelle de rayonnement de 0,3 mSv. La dose efficace réelle varie considérablement, étant surtout déterminée par la teneur du sol local en uranium et en thorium. Dans les régions du monde où on trouve du sable monazite, la dose efficace annuelle reçue par chaque individu peut atteindre près de 20 mSv. A d’autres endroits, comme les atolls coralliens et les bords de mer, elle peut être d’à peine 0,03 mSv (voir figure 48.17).
Considéré généralement à part des autres radionucléides naturels, le radon se dégage lentement du sol pour atteindre l’atmosphère. Une fois dans l’air, il se désintègre pour former des radio-isotopes de polonium (Po), de bismuth (Bi) et de plomb (Pb). Ces descendants se fixent sur des particules de poussière qui peuvent alors être inspirées et rester dans les poumons. On estime en moyenne à environ 20 mSv l’équivalent de dose annuel absorbé par les poumons, ce qui est comparable à une dose efficace d’environ 2 mSv reçue par le corps entier. De toute évidence, le radon et ses descendants radioactifs constituent la composante la plus importante du rayonnement naturel auquel nous sommes soumis (voir figure 48.17).
Les rayons cosmiques comprennent des particules énergétiques d’origine extraterrestre qui viennent bombarder l’atmosphère (le rayonnement étant essentiellement particulaire et surtout formé de protons). Ils comportent également des particules secondaires — principalement des photons, des neutrons et des muons — engendrées par l’interaction des particules primaires avec les gaz atmosphériques.
A cause de ces interactions, l’atmosphère joue le rôle d’un écran protecteur contre le rayonnement cosmique: plus l’écran est mince, plus la dose efficace est grande. Par conséquent, le débit de dose efficace dû à ce rayonnement augmente avec l’altitude. Ainsi, le débit à 1 800 m d’altitude est le double de celui qui existe au niveau de la mer.
Comme le rayonnement cosmique primaire consiste surtout en particules chargées, il est influencé par le champ magnétique terrestre. Cela revient à dire que les habitants des hautes latitudes reçoivent des doses efficaces plus importantes que les populations vivant près de l’équateur. Les variations dues à cet effet sont de l’ordre de 10%.
Enfin, le débit de dose efficace dû au rayonnement cosmique varie avec les fluctuations de l’activité solaire. En moyenne, la contribution des rayons cosmiques au rayonnement naturel est d’environ 0,3 mSv de dose efficace au corps entier.
Le rayonnement cosmique engendre des radionucléides dans l’atmosphère, par interaction avec les gaz atmosphériques. Les plus importants sont le tritium (3H), le béryllium (7Be), le carbone (14C) et le sodium (22Na). Ces radionucléides sont responsables d’une dose efficace annuelle d’environ 0,01 mSv, dont la plus grande partie est due au14C.
De nombreux essais d’armes nucléaires ont été réalisés dans l’atmosphère entre les années quarante et les années soixante, produisant d’importantes quantités de substances radioactives qui se sont dispersées dans l’environnement, partout dans le monde, sous forme de retombées . Même si la plupart de ces substances se sont désintégrées depuis, engendrant des isotopes stables, les petites quantités qui restent continueront à agir comme sources d’irradiation pendant très longtemps encore. De plus, les pays qui procèdent encore à l’occasion à des essais nucléaires dans l’atmosphère augmentent ces quantités.
Les principaux constituants des retombées qui contribuent à la dose efficace comprennent actuellement le strontium 90 (90Sr) et le césium 137 (137Cs), qui ont tous deux une période radioactive d’environ trente ans. La dose efficace annuelle moyenne due aux retombées s’élève à environ 0,05 mSv.
Le dépôt de radionucléides naturels dans l’organisme résulte principalement de leur inhalation dans l’air et de leur ingestion dans les aliments et l’eau. Ils comprennent les radio-isotopes du plomb (Pb), du polonium (Po), du bismuth (Bi), du radium (Ra), du potassium (K), du carbone (C), de l’hydrogène (H), de l’uranium (U) et du thorium (Th). Parmi ces éléments, le potassium40K est le plus important contributeur à la dose. Les radionucléides naturels déposés dans l’organisme ont une contribution d’environ 0,3 mSv à la dose efficace annuelle.
L’utilisation médicale des rayons X constitue la source d’exposition la plus importante aux rayonnements artificiels. Des millions de tubes à rayons X sont en service dans le monde. L’exposition moyenne provenant de cette source dépend dans une grande mesure de l’accès de la population aux soins médicaux. Dans les pays développés, la dose efficace annuelle provenant de l’utilisation médicale des rayons X et de substances radioactives à des fins diagnostiques et thérapeutiques est en moyenne de l’ordre de 1 mSv.
Par ailleurs, les rayons X sont un sous-produit de la plupart des accélérateurs de particules à haute énergie utilisés par les physiciens, et surtout de ceux qui servent à accélérer des électrons et des positons. Toutefois, les blindages, les précautions prises et l’effectif limité de la population exposée font que cette source d’exposition est sensiblement moins importante que les précédentes.
Les réactions nucléaires qui se produisent dans les accélérateurs de particules donnent naissance à un grand nombre de radionucléides en quantités diverses. Les particules accélérées comprennent des protons, des deutons (noyaux de2H), des particules alpha, des mésons chargés, des ions lourds, etc. Les cibles peuvent être faites de quasiment tout isotope.
Les accélérateurs de particules sont en pratique la seule source de radio-isotopes émetteurs de positons (les réacteurs nucléaires tendent à produire des radio-isotopes riches en neutrons qui se désintègrent en émettant des électrons négatifs). On s’en sert également de plus en plus pour obtenir des isotopes de courte période utilisés à des fins médicales, notamment en tomographie par émission de positons.
Des rayons X et matières radioactives sont produits par de très nombreuses opérations techniques modernes, de façon délibérée ou non. Le tableau 48.10 énumère quelques-unes des sources de rayonnement les plus courantes.
|
Groupe I — Produits de grande consommation avec de très fortes doses efficaces individuelles |
|
|
Produits du tabac |
Carburants |
|
Réseaux publics de distribution d’eau |
Verre et céramique |
|
Matériaux de construction |
Verres correcteurs |
|
Produits miniers et agricoles |
|
|
Groupe II — Produits touchant un grand nombre de personnes, avec des doses efficaces relativement petites ou n’affectant qu’une petite partie du corps |
|
|
Téléviseurs |
Matériaux de construction de routes et de voies publiques |
|
Produits radioluminescents |
Transport de matières radioactives par avion |
|
Systèmes d’inspection aéroportuaires |
Irradiateurs à éclateurs et tubes électroniques |
|
Détecteurs de gaz et d’aérosols (fumée) |
Produits du thorium: démarreurs de tubes fluorescents et manchons incandescents |
|
Groupe III — Produits ne touchant qu’un petit nombre de personnes, avec de faibles doses efficaces collectives |
|
|
Produits du thorium: électrodes de soudage en tungstène |
|
Source: National Council on Radiation Protection and Measurements (NCRP), 1987.
Les dangers associés à la manipulation et à l’utilisation de sources de rayonnement imposent d’adopter des caractéristiques spéciales de conception et de construction qui ne sont pas nécessaires dans les laboratoires et les lieux de travaux classiques. Ces caractéristiques sont incorporées dans l’installation de façon à éviter une gêne excessive aux travailleurs sans toutefois les exposer à des risques indus de rayonnement externe ou interne.
Il est nécessaire à cet effet de contrôler l’accès de toutes les zones où pourraient se trouver des sources de rayonnement ou des matières radioactives, non seulement en désignant les travailleurs autorisés à y entrer, mais aussi en précisant les types de vêtements ou d’équipements de protection à porter et les précautions à observer quand ils s’y trouvent. Il est utile, pour l’administration de telles mesures de contrôle, de classer les lieux de travail selon la présence de rayonnements ionisants, d’une contamination radioactive ou des deux. L’introduction de tels concepts de classification des lieux de travail aux premiers stades de planification permet de doter l’installation de toutes les caractéristiques nécessaires pour réduire le danger des opérations effectuées sur des sources de rayonnement.
Pour classer les lieux de travail, il est utile de commencer par grouper les radionucléides selon leur radiotoxicité relative par unité d’activité. Le groupe I comprend les éléments à très haute toxicité, le groupe II les éléments à haute toxicité, le groupe III les éléments à toxicité modérée et le groupe IV les éléments à faible toxicité. Le tableau 48.11 présente une classification de nombreux radionucléides selon leur groupe de radiotoxicité.
|
Groupe I: très haute toxicité |
|||||||||
|
210 Pb |
210 Po |
223 Ra |
226 Ra |
228 Ra |
227 Ac |
227 Th |
228 Th |
230 Th |
231 Pa |
|
230 U |
232 U |
233 U |
234 U |
237 Np |
238 Pu |
239 Pu |
240 Pu |
241 Pu |
242 Pu |
|
241 Am |
243 Am |
242 Cm |
243 Cm |
244 Cm |
245 Cm |
246 Cm |
249 Cm |
250 Cf |
252 Cf |
|
Groupe II: haute toxicité |
|||||||||
|
22 Na |
36 Cl |
45 Ca |
46 Sc |
54 Mn |
56 Co |
60 Co |
89 Sr |
90 Sr |
91 Y |
|
95 Zr |
106 Ru |
110 Agm |
115 Cdm |
114 Inm |
124 Sb |
125 Sb |
127 Tem |
129 Tem |
124 I |
|
126 I |
131 I |
133 I |
134 Cs |
137 Cs |
140 Ba |
144 Ce |
152 Eu(13 ans) |
154 Eu |
160 Tb |
|
170 Tm |
181 Hf |
210 Bi |
182 Ta |
192 Ir |
204 Tl |
207 Bi |
230 Pa |
211 At |
212 Pb |
|
224 Ra |
228 Ac |
234 Th |
236 U |
249 Bk |
|||||
|
Groupe III: toxicité modérée |
|||||||||
|
7 Be |
14 C |
18 F |
24 Na |
38 Cl |
31 Si |
32 P |
35 S |
41 A |
42 K |
|
43 K |
47 Sc |
48 Sc |
48 V |
51 Cr |
52 Mn |
56 Mn |
52 Fe |
55 Fe |
59 Fe |
|
57 Co |
53 Ni |
65 Ni |
64 Cu |
65 Zn |
69 Znm |
72 Ga |
73 As |
74 As |
76 As |
|
77 As |
82 Br |
85 Krm |
87 Kr |
86 Rb |
85 Sr |
91 Sr |
90 Y |
92 Y |
93 Y |
|
97 Zr |
95 Nb |
99 Mo |
96 Tc |
97 Tcm |
97 Tc |
99 Tc |
97 Ru |
103 Ru |
105 Ru |
|
105 Rh |
109 Pd |
105 Ag |
111 Ag |
109 Cd |
115 Cd |
115 Inm |
113 Sn |
125 Sn |
122 Sb |
|
125 Tem |
129 Te |
131 Tem |
132 Te |
130 I |
132 I |
134 I |
135 I |
135 Xe |
131 Cs |
|
136 Cs |
140 La |
141 Ce |
143 Ce |
142 Pr |
143 Pr |
147 Nd |
149 Nd |
147 Pm |
149 Pm |
|
151 Sm |
152 Eu(9,2 h) |
155 Eu |
153 Gd |
159 Gd |
165 Dy |
166 Dy |
166 Ho |
169 Er |
171 Er |
|
171 Tm |
177 Lu |
181 W |
185 W |
187 W |
183 Re |
186 Re |
188 Re |
185 Os |
191 Os |
|
193 Os |
190 Ir |
195 Ir |
191 Pt |
193 Pt |
197 Pt |
196 Au |
198 Au |
199 Au |
197 Hg |
|
197 Hgm |
203 Hg |
200 Tl |
201 Tl |
202 Tl |
203 Pb |
206 Bi |
212 Bi |
220 Rn |
222 Rn |
|
231 Th |
233 Pa |
239 Np |
|||||||
|
Groupe IV: faible toxicité |
|||||||||
|
3 H |
15 O |
37 A |
58 Com |
59 Ni |
69 Zn |
71 Ge |
85 Kr |
85 Srm |
87 Rb |
|
91 Ym |
93 Zr |
97 Nb |
96 Tcm |
99 Tcm |
103 Rhm |
133 Inm |
129 I |
131 Xem |
133 Xe |
|
134 Csm |
135 Cs |
147 Sm |
187 Re |
191 Osm |
193 Ptm |
197 Ptm |
natTh |
232 Th |
235 U |
|
238 U |
natU |
||||||||
Source: AIEA, 1973.
On peut définir trois types principaux de laboratoires en se basant sur les considérations de radiotoxicité, les quantités de matières radioactives devant être manipulées dans les lieux de travail et le genre d’opérations en cause.
Le tableau 48.12 présente une description des différents types de laboratoires et donne des exemples de chacun. Le tableau 48.13 montre les types de laboratoires ainsi que la classification des lieux de travail et les mesures correspondantes de contrôle de l’accès (AIEA, 1973).
|
Type |
Définition |
Contrôle de l’accès |
Exemples de lieux de travail |
|
1 |
Zones dans lesquelles les doses absorbées de rayonnement externe ou les niveaux de contamination radioactive peuvent être élevés |
Accès limité aux travailleurs sous rayonnement munis d’un équipement de protection adéquat et travaillant dans des conditions strictement contrôlées |
Laboratoires chauds, zones hautement contaminées |
|
2 |
Zones pouvant être soumises à des rayonnements externes et où les risques de contamination radioactive rendent nécessaires des consignes d’exploitation |
Accès limité aux travailleurs sous rayonnement munis de vêtements et de chaussures de protection adéquats |
Usines de produits luminescents et établissements équivalents |
|
3 |
Zones dans lesquelles le niveau moyen de rayonnement externe est inférieur à 1 mGy par semaine et où les risques de contamination radioactive rendent nécessaires des consignes d’exploitation spéciales |
Accès limité aux travailleurs sous rayonnement. Le port de vêtements de protection n’est pas nécessaire |
Locaux de travail dans le voisinage immédiat d’une installation de radiographie, par exemple, une salle de commande |
|
4 |
Zones d’une installation radiologique dans lesquelles le niveau de rayonnement externe est inférieur à 0,1 mGy par semaine et où aucune contamination radioactive n’est présente |
Accès non contrôlé |
Locaux administratifs et salles d’attente des malades |
Sources: CIPR, 1977; AIEA, 1973.
|
Groupe de radionucléides |
Type de laboratoire prescrit selon l’activité |
||
|
Type 1 |
Type 2 |
Type 3 |
|
|
I |
<370 kBq |
70 kBq à 37 MBq |
>37 MBq |
|
II |
<37 MBq |
37 MBq à 37 GBq |
>37 GBq |
|
III |
<37 GBq |
37 GBq à 370 GBq |
>370 GBq |
|
IV |
<370 GBq |
370 GBq à 37 TBq |
>37 TBq |
|
Conditions pratiques d’utilisation des matières radioactives dans le laboratoire |
Facteur de multiplication s’appliquant aux niveaux d’activité |
||
|
Simple entreposage |
× 100 |
||
|
Opérations simples en milieu humide (par exemple, préparation d’aliquotes d’une solution-mère) |
× 10 |
||
|
Opérations chimiques ordinaires (par exemple, préparations et analyses chimiques simples) |
× 1 |
||
|
Opérations complexes en milieu humide (par exemple, opérations multiples ou opérations nécessitant l’utilisation d’une verrerie complexe) |
× 0,1 |
||
|
Opérations à sec simples (par exemple, manipulation de composés radioactifs volatils en poudre) |
× 0,1 |
||
|
Opérations à sec en milieu poussiéreux (par exemple, broyage) |
× 0,01 |
||
Sources: CIPR, 1977; AIEA, 1973.
Le danger qu’il y a à travailler sur des matières radioactives dépend non seulement du niveau de radiotoxicité, de toxicité chimique et d’activité des radionucléides, mais aussi des caractéristiques physiques et chimiques des matières ainsi que de la nature et de la complexité de l’opération ou du processus à exécuter.
Lorsqu’une installation radiologique doit faire partie d’un grand bâtiment, il importe de tenir compte des principes ci-après au moment de son implantation.
Si l’on envisage une gradation des niveaux d’activité, le laboratoire devrait être aménagé de façon que l’accès aux zones à haut rayonnement ou à forte contamination radioactive soit graduel; on entrerait d’abord dans une zone sans rayonnement, puis on passerait successivement dans les zones à faible activité, à activité moyenne et ainsi de suite.
On peut éviter les systèmes de ventilation complexes dans les petits laboratoires en recourant à des hottes et à des boîtes à gants pour manipuler des sources non scellées de substances radioactives. Toutefois, le système de ventilation devrait être conçu de façon que la circulation de l’air emporte toute matière radioactive en suspension loin des travailleurs. L’air devrait toujours circuler des zones non contaminées vers les zones qui sont ou peuvent être contaminées.
Pour la manipulation de sources non scellées de faible ou de moyenne activité, la vitesse moyenne de l’air passant par l’orifice de la hotte doit être maintenue à environ 0,5 m/s. Dans le cas de sources hautement radiotoxiques ou à haute activité, la vitesse moyenne de l’air devrait être portée à 0,6 à 1,0 m/s. Il ne faut cependant pas perdre de vue que si l’air circule à des vitesses élevées, il risque d’aspirer des matières radioactives se trouvant dans des récipients ouverts et de contaminer ainsi toute la zone de la hotte.
L’emplacement de la hotte dans le laboratoire est important par rapport aux courants d’air. En général, elle devrait être placée bien à l’écart des prises d’air extérieur ou d’air d’appoint. Une soufflerie à deux vitesses permet d’augmenter la circulation d’air pendant qu’on utilise la hotte, puis de passer à la petite vitesse lorsqu’elle est fermée.
L’objet de tout système de ventilation devrait être:
Lors de la conception des installations radiologiques, on peut réduire les besoins de blindages épais en adoptant certaines mesures simples. Par exemple, dans le cas des installations de radiothérapie, des accélérateurs, des générateurs de neutrons ou des sources de rayonnement panoramiques, un labyrinthe peut souvent remplacer une lourde porte doublée de plomb. En diminuant l’épaisseur de l’écran primaire de radioprotection dans les zones qui ne se trouvent pas directement dans le faisceau utile ou en plaçant l’installation partiellement ou complètement sous terre, on peut réduire sensiblement les besoins de blindage.
Il convient de porter une attention particulière au positionnement des hublots d’observation, des câbles passant dans des canalisations souterraines et des chicanes du système de ventilation. Le hublot d’observation ne devrait intercepter que le rayonnement diffusé. Il vaut d’ailleurs mieux recourir à la télévision en circuit fermé, qui est en même temps plus efficace.
Toutes les surfaces rugueuses — plâtre, béton, bois, etc. — devraient recevoir un revêtement lisse permanent d’un matériau approprié. Le choix de ce matériau doit tenir compte des considérations suivantes:
Les peintures, vernis et enduits ordinaires ne sont pas recommandés pour les surfaces d’usure. Il pourrait être utile d’envisager un matériau de revêtement pouvant être facilement enlevé en cas de contamination. Il ne faudrait cependant pas perdre de vue que l’enlèvement de tels matériaux peut lui-même s’avérer difficile et être une source de contamination.
Eviers, lavabos et drains de sol devraient porter des indications adéquates. Les lavabos à utiliser pour se laver les mains en cas de contamination devraient être équipés de commandes au genou ou au pied. Il pourrait être économique de réduire la maintenance en se servant d’une tuyauterie pouvant être facilement décontaminée ou remplacée, au besoin. Il est préférable, dans certains cas, d’installer des réservoirs souterrains de reprise ou de stockage pour contrôler l’élimination des liquides radioactifs.
Les écrans sont importants pour réduire l’exposition des travailleurs et du public. Les besoins de protection dépendent de nombreux facteurs, notamment la durée de l’exposition aux sources de rayonnement ainsi que le type et l’énergie des sources et des champs de rayonnement.
Au moment de la conception des écrans de protection, il faudrait s’efforcer autant que possible de placer le matériau écran à proximité de la source. Il importe en outre d’examiner séparément les besoins de protection correspondant à chaque type de rayonnement en cause.
La conception des écrans peut être une tâche complexe. On recourt par exemple à la modélisation informatique pour étudier la protection des accélérateurs, des réacteurs et d’autres sources de rayonnements à haute énergie, mais ce sont là des questions qui débordent le cadre du présent article. Il faudrait toujours faire appel à des experts pour régler les problèmes complexes de protection par écrans.
L’atténuation des rayons gamma est qualitativement différente de celle des rayonnements alpha ou bêta. En effet, ces deux derniers types de rayonnement ont un parcours de longueur déterminée dans la matière et sont complètement absorbés. Il n’en est pas de même des rayons gamma dont l’intensité baisse lorsqu’ils traversent des épaisseurs croissantes d’absorbant, mais qui ne sont jamais complètement absorbés. Si l’atténuation de rayons gamma monoénergétiques est mesurée dans de bonnes conditions de géométrie (c’est-à-dire quand le rayonnement est bien collimaté dans un faisceau étroit), le tracé, sur échelle semi-logarithmique, des données d’intensité en fonction de l’épaisseur de l’absorbant est une ligne droite ayant pour pente le coefficient d’atténuation µ.
L’intensité, ou le débit de dose absorbée transmis à travers un absorbant, peut être exprimée par la formule:
où It est l’intensité des rayons gamma ou le débit de dose absorbée transmis à travers un absorbant d’épaisseur t.
Les unités de µ et t sont des inverses si l’épaisseur de l’absorbant t est mesurée en cm, le coefficient d’atténuation linéaire µ est mesuré en cm–1. De même, si t est exprimé en unités de masse par unité de surface (g/cm2), µ est alors le coefficient d’atténuation massique désigné µm et mesuré en cm2/g.
On peut dire, comme approximation de premier ordre, qu’à masse surfacique égale tous les matériaux ont les mêmes propriétés d’absorption de photons, tant que l’énergie de ces derniers se situe entre environ 0,75 et 5 MeV (mégaélectronvolts). Dans cet intervalle, la protection contre les rayons gamma est à peu près proportionnelle à la masse surfacique du matériau de l’écran. Dans le cas des photons ayant moins ou plus d’énergie, les absorbants à numéro atomique élevé assurent une protection plus efficace que les absorbants à numéro atomique bas, pour une masse surfacique donnée.
Dans des conditions défavorables de géométrie (par exemple, si le faisceau est large ou l’écran épais), l’équation précédente sous-estimera sensiblement l’épaisseur nécessaire de l’écran parce qu’elle se fonde sur l’hypothèse que chaque photon qui interagit avec l’écran est intercepté et n’est donc pas détecté. En réalité, l’écran peut transmettre au détecteur de nombreux photons diffusés; de plus, des photons diffusés hors du faisceau peuvent y être renvoyés après une deuxième interaction.
Dans des conditions défavorables de géométrie, on peut estimer l’épaisseur nécessaire de l’écran en tenant compte du facteur d’accumulation B, qui est calculé comme suit:
Le facteur d’accumulation est toujours supérieur à l’unité. Par définition, c’est le rapport de l’intensité du rayonnement électromagnétique primaire et diffusé en un point quelconque du faisceau à l’intensité du seul faisceau primaire au même point. Le facteur d’accumulation s’applique tant au flux de rayonnement qu’au débit de dose absorbée.
On a calculé les facteurs d’accumulation correspondant à différentes énergies de rayonnement et à différents absorbants. De nombreux graphiques et tableaux produits à cet égard donnent l’épaisseur de l’écran en longueurs de relaxation. Cette dernière grandeur représente l’épaisseur d’un écran capable d’atténuer un faisceau étroit d’un facteur égal à 1/e (environ 37%). Par conséquent, la longueur de relaxation est numériquement égale à l’inverse du coefficient d’atténuation linéaire (c’est-à-dire à 1/µ).
L’épaisseur d’un absorbant qui, introduit dans un faisceau de (photons) primaire, réduit le débit de dose absorbée de moitié est dite couche de demi-atténuation (CDA, ou HVL (Half-value Layer)) ou épaisseur de demi-atténuation (HVT, ou Half-value Thickness). La CDA est calculée comme suit:
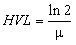
On peut commencer par estimer l’épaisseur de l’écran antiphotons en supposant des conditions de faisceau étroit ou de bonne géométrie, puis en majorant la valeur obtenue d’une CDA pour tenir compte de l’accumulation.
L’épaisseur d’un absorbant qui, introduit dans un faisceau (de photons) primaire, réduit le débit de dose absorbée à un dixième de sa valeur est dite couche de décitransmission (CDT, ou TVL (Tenth-value Layer)). La CDT est égale à environ 3,32 fois la CDA puisque:
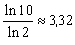
On peut trouver des tableaux de la CDA et de la CDT pour différentes énergies de rayonnements photoniques et différents matériaux courants de blindage, comme le plomb, l’acier et le béton (Schaeffer, 1973).
Pour une source ponctuelle, l’intensité ou le débit de dose absorbée est conforme à la loi de l’inverse des carrés et peut se calculer comme suit:
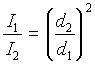
I1 étant l’intensité du rayonnement ou le débit de dose absorbée à une distance d1 de la source.
L’équipement à rayons X est considéré sous deux aspects: blindage de la source et protection des locaux. Le blindage de la source est ordinairement fourni par le constructeur de la gaine du tube à rayons X.
Les règlements de sécurité prescrivent un type de gaine protectrice pour les installations médicales de radiodiagnostic et un autre pour les installations médicales de radiothérapie aux rayons X. Dans le cas de l’équipement non médical, l’enveloppe du tube et d’autres parties de l’appareil à rayons X, comme le transformateur, doivent être blindées pour réduire le rayonnement de fuite X à des niveaux acceptables.
Tous les appareils à rayons X, qu’ils soient médicaux ou non, ont des gaines protectrices conçues pour limiter le rayonnement de fuite. Dans les spécifications des gaines, le rayonnement de fuite désigne tout rayonnement autre que le rayonnement utile qui traverse la gaine.
Le blindage des locaux abritant l’équipement à rayons X a pour but de protéger les personnes présentes contre le rayonnement utile ou primaire, le rayonnement de fuite et le rayonnement diffusé. Il entoure tant l’équipement que les personnes ou les objets à irradier.
L’intensité du rayonnement diffusé dépend de l’étendue du champ d’irradiation, de l’énergie du faisceau utile, du numéro atomique effectif du milieu diffusant et de l’angle formé par le faisceau utile incident et la direction de la diffusion.
La charge de travail W de l’installation constitue un important paramètre de conception:
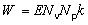
W étant la charge de travail hebdomadaire, ordinairement exprimée en mA·min par semaine, E l’intensité du courant dans le tube multiplié par le temps d’exposition par cliché, ordinairement exprimé en mAs, Nv le nombre de clichés par patient ou par objet irradié, Np le nombre de patients ou d’objets par semaine et k un facteur de conversion (1 min divisée par 60 s).
Le facteur d’utilisation Un d’un mur (ou d’un sol ou d’un plafond) n est un autre paramètre de conception important. Le mur peut servir à protéger n’importe quel local occupé comme une salle de commande, un bureau ou une salle d’attente. Le facteur d’utilisation est donné par la formule:
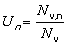
où Nv,n est le nombre de clichés pris pendant que le faisceau primaire de rayons X est orienté en direction du mur n.
Les exigences de protection des locaux pour une installation donnée de rayons X sont déterminées par les facteurs suivants:
Une fois toutes ces considérations prises en compte, la valeur du rapport ou facteur de transmission K du faisceau primaire, en mGy par mA·min à 1 m, est donnée par la formule:
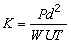
Le blindage de l’installation doit être construit de façon que la protection ne soit réduite ni par les joints et les ouvertures ménagées pour les conduits, tuyaux, etc. devant passer à travers les cloisons, ni par les canalisations ou les coffrets de branchement qui y sont encastrés. Le blindage devrait couvrir non seulement l’arrière des coffrets de branchement, mais aussi leurs côtés, ou s’étendre suffisamment pour assurer une protection équivalente. Les canalisations traversant les cloisons devraient comporter suffisamment de coudes pour atténuer le rayonnement au niveau requis. Les hublots d’observation doivent avoir un blindage équivalent à celui de la cloison (écran) ou de la porte dans laquelle ils sont placés.
Les installations de radiothérapie peuvent nécessiter des dispositifs d’interverrouillage de portes, des voyants lumineux, un système de télévision en circuit fermé ou un moyen de communication acoustique (en phonie ou par sonnette) et visuel entre la personne traitée et l’opérateur.
Les écrans de radioprotection sont de deux types:
Pour concevoir l’écran secondaire, on doit calculer séparément l’épaisseur nécessaire pour assurer la protection requise contre chacune des composantes. Si ces épaisseurs sont à peu près les mêmes, il suffit d’ajouter une CDA à la plus grande des épaisseurs calculées. Si le plus grand écart entre les épaisseurs calculées atteint ou dépasse une CDA, la plus grande épaisseur calculée devrait suffire.
L’intensité du rayonnement diffusé dépend de l’angle de diffusion, de l’énergie du faisceau utile, de l’étendue du champ ou de la zone de diffusion et de la composition du sujet.
Lors de la conception des écrans secondaires de radioprotection, on peut, par souci de simplification, poser les hypothèses prudentes qui suivent:
La relation de transmission du rayonnement diffusé s’exprime en fonction du facteur de transmission par diffusion Kµx en mGy·m2 (mA·min)–1:
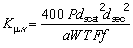
P étant le débit hebdomadaire maximal de dose absorbée (en mGy), ddiff la distance entre la cible du tube à rayons X et l’objet (patient), dsec la distance entre le diffuseur (objet) et le point considéré (que les écrans secondaires sont censés protéger), a le rapport du rayonnement diffusé au rayonnement incident, f l’étendue effective du champ de diffusion (en cm2), et F un facteur destiné à tenir compte du fait que l’intensité des rayons X produits augmente avec la tension. Plus Kµx est petit, plus les écrans doivent être épais.
Pour les systèmes de radiodiagnostic, le facteur d’atténuation du rayonnement de fuite BLX est ainsi calculé:
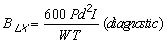
d étant la distance entre la cible du tube et le point considéré et I l’intensité du courant dans le tube en mA.
Dans le cas des systèmes de radiothérapie à rayons X fonctionnant à 500 kV ou moins, le facteur d’atténuation requis est donné par la formule:

Dans le cas des systèmes de radiothérapie fonctionnant à plus de 500 kV, le rayonnement de fuite se limite en général à 0,1% de l’intensité du faisceau utile à 1 m. Dans ce cas, le facteur d’atténuation requis est donné par:
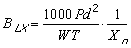
où Xn est le débit de dose absorbée (en mGy/h) à 1 m d’un tube de radiothérapie à rayons X fonctionnant à 1 mA.
Le nombre n de CDA nécessaire pour obtenir l’atténuation requise BLX est donné par la formule:
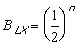
ou
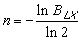
Il faut tenir compte de deux facteurs dans la conception d’un écran de protection contre un émetteur bêta: les particules bêta elles-mêmes et le rayonnement de freinage (d’après le terme allemand Bremsstrahlung) produit par l’absorption des particules bêta dans la source et dans l’écran. Le rayonnement de freinage consiste en photons X émis lorsque des particules chargées se déplaçant à grande vitesse subissent une décélération rapide.
Par conséquent, l’écran bêta a souvent deux couches: une substance de faible numéro atomique (afin de réduire le rayonnement de freinage produit) d’une épaisseur suffisante pour arrêter toutes les particules bêta, suivie d’une substance de numéro atomique élevé assez épaisse pour atténuer suffisamment le rayonnement de freinage résiduel (en inversant l’ordre des deux couches, on intensifierait à tel point le rayonnement de freinage produit sur la première couche que la seconde pourrait ne pas assurer une protection suffisante).
On peut se servir de la formule suivante pour estimer le danger du rayonnement de freinage:
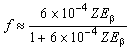
f étant la fraction de l’énergie bêta incidente convertie en photons, Z le numéro atomique de l’absorbant et Eβ l’énergie maximale du spectre bêta en MeV. Pour assurer une protection adéquate, on suppose d’habitude que tous les photons du rayonnement de freinage ont l’énergie maximale.
Le flux du rayonnement de freinage (Bremsstrahlung) Φ à la distance d de la source bêta peut être estimé par la formule suivante:
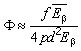
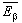 est l’énergie moyenne des particules bêta, que l’on peut estimer ainsi:
est l’énergie moyenne des particules bêta, que l’on peut estimer ainsi:
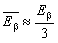
Le parcours Rβ des particules bêta en unités de masse surfacique (mg/cm2) peut être estimé à l’aide de la formule suivante pour les particules de 0,01 à 2,5 MeV:
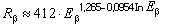
Rβ étant exprimé en mg/cm2 et Eβ en MeV.
Si Eβ dépasse 2,5 MeV, le parcours Rβ des particules bêta peut être estimé ainsi:
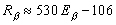
Rβ étant exprimé en mg/cm2 et Eβ en MeV.
Le rayonnement alpha est le moins pénétrant de tous les rayonnements ionisants. Par suite de la nature aléatoire de ses interactions, chaque particule alpha a un parcours qui se situe entre les valeurs nominales indiquées dans la figure 48.18. Dans le cas des particules alpha, le parcours est exprimé de différentes façons: parcours minimum, moyen, extrapolé ou maximum. Correspondant à la particule alpha «moyenne», le parcours moyen est celui que l’on peut calculer avec le plus de précision. C’est aussi celui que l’on utilise le plus souvent.
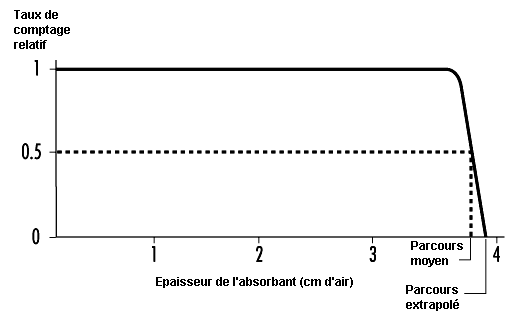
L’air est le milieu absorbant dont on se sert le plus couramment pour définir la relation parcours-énergie des particules alpha. Pour une énergie alpha Eα inférieure autour de 4 MeV, le parcours dans l’air Rα est donné approximativement par:
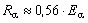
Rα étant exprimé en cm et Eα en MeV.
Pour une énergie Eα comprise entre 4 et 8 MeV, le parcours dans l’air Rα est donné approximativement par:
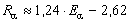
Rα étant exprimé en cm et Eα en MeV.
Le parcours des particules alpha dans des milieux autres que l’air peut être déduit de la relation suivante:
Rα (milieu autre que l’air, mg/cm2) ~ 0,56 A1/3 Rα (dans l’air, cm)
A étant le numéro atomique de l’autre milieu.
On peut considérer, en gros, pour le calcul des écrans, que les neutrons atteignent un état d’équilibre énergétique ou thermodynamique et s’y maintiennent après avoir franchi une ou deux longueurs de relaxation dans le matériau d’un écran. Par conséquent, pour un écran de béton ou d’acier d’une épaisseur supérieure à quelques longueurs de relaxation, l’équivalent de dose sera atténué par des longueurs de relaxation de 120 g/cm2 (béton) ou de 145 g/cm2 (acier).
Pour absorber l’énergie des neutrons par diffusion élastique, il faut recourir à un écran hydrogéné afin de favoriser au maximum le transfert d’énergie pendant que les neutrons sont modérés (ralentis). Aux énergies supérieures à 10 MeV, les processus inélastiques atténuent efficacement les neutrons.
Comme les réacteurs nucléaires, les accélérateurs à haute énergie doivent avoir un épais blindage pour protéger les travailleurs. La plus grande partie de l’équivalent de dose qu’ils reçoivent est due à l’exposition à des matières activées au cours des travaux de maintenance. Les produits d’activation sont engendrés dans les constituants et le matériel auxiliaire de l’accélérateur.
Il importe de distinguer les programmes de contrôle périodique des programmes de contrôle opérationnel de l’environnement des lieux de travail. Chaque programme est conçu pour atteindre des objectifs particuliers. Il n’est donc pas recommandé de concevoir des programmes en fonction de critères généraux.
Il importe, dans le cadre d’un programme de contrôle périodique des rayonnements extérieurs en milieu de travail, de réaliser une enquête approfondie chaque fois qu’une nouvelle source de rayonnement ou une nouvelle installation est mise en service ou que des changements importants sont apportés ou pourraient avoir été apportés à une installation existante.
La fréquence du contrôle périodique est déterminée par les changements attendus de l’environnement soumis aux rayonnements. Si les changements apportés à l’équipement protecteur ou aux opérations exécutées dans les lieux de travail sont minimes ou sans conséquence, il est rarement nécessaire de procéder au contrôle périodique des rayonnements pour fins d’examen. Si les champs de rayonnement sont susceptibles d’augmenter rapidement et de façon imprévisible jusqu’à des niveaux dangereux, il est nécessaire d’installer un système de surveillance radiologique et de signalisation de zone.
La conception d’un programme de contrôle opérationnel dépend dans une large mesure de l’influence que les opérations à exécuter ont sur les champs de rayonnement: s’attend-on à ce que ces champs varient ou demeurent pratiquement constants en fonctionnement normal? La conception détaillée d’un tel programme dépend de façon déterminante de la nature des opérations et des conditions dans lesquelles elles sont exécutées.
La méthode classique de contrôle périodique de la contamination de surface consiste à surveiller une fraction représentative des surfaces d’une zone, à une fréquence déterminée en fonction de l’expérience. Si les opérations sont de nature à produire une importante contamination de surface et sont telles que les travailleurs risquent d’emporter sur eux en quittant les lieux de travail des quantités appréciables de matières radioactives en une fois, il faudrait, en sus du contrôle périodique, installer des détecteurs de contamination à la sortie des locaux.
L’une des formes de contrôle opérationnel consiste à vérifier la contamination de tout ce qui sort d’une zone radiologique contrôlée. Le contrôle doit porter en particulier sur les mains et les pieds des travailleurs.
Les principaux objectifs d’un programme de contrôle de la contamination de surface sont les suivants:
Le contrôle des contaminants radioactifs en suspension dans l’air est important parce que l’inhalation est ordinairement la plus importante source d’absorption de matières radioactives pour les travailleurs sous rayonnement. Il est nécessaire de procéder à un contrôle périodique de ces contaminants sur les lieux de travail dans les circonstances suivantes:
Si l’on juge nécessaire d’établir un programme de contrôle de l’air ambiant, il doit permettre:
Le moyen le plus courant de contrôle des contaminants aériens en suspension consiste à placer des appareils à prélèvement d’air à un certain nombre d’endroits choisis de façon à donner un échantillon représentatif de l’air inspiré par les travailleurs exposés. Il peut s’avérer nécessaire d’obtenir des échantillons plus représentatifs en recourant à des appareils à prélèvement d’air individuels ou pouvant même être portés en boutonnière.
Le contrôle par frottis et l’inspection à l’aide d’appareils de mesure des surfaces de travail, des sols, de la peau et d’autres surfaces ne sont au mieux que des moyens qualitatifs pouvant difficilement donner des résultats quantitatifs précis, les appareils utilisés étant en général plus aptes à la détection qu’au mesurage. Comme les quantités de radioactivité en jeu sont souvent petites, la sensibilité des appareils devrait être élevée.
Le besoin de détecteurs de contamination portables dépend de l’utilisation que l’on veut en faire. Si l’appareil doit servir à un contrôle général des surfaces de travail, il est commode de disposer d’un modèle portable. Par contre, s’il s’agit d’un appareil spécialisé et qu’il est possible de déplacer l’objet à contrôler, un modèle fixe suffit. Les détecteurs servant à contrôler les vêtements, les mains et les chaussures ne sont pas en général portables.
Les compteurs et détecteurs comportent ordinairement un affichage et une sortie sonore ou une prise d’écouteur. Le tableau 48.14 répertorie les appareils qu’il est possible d’utiliser pour détecter la contamination radioactive.
|
Appareil |
Echelle de comptage et autres caractéristiques1 |
Applications typiques |
Observations |
|
Détecteurs de surface β et γ2 |
|||
|
Applications générales |
|||
|
Compteur (compteur G-M3 à paroi ou fenêtre mince) |
0-1 000 i/min |
Surfaces, mains, vêtements |
Simple, fiable, alimenté par piles |
|
Compteur G-M de laboratoire à fenêtre mince |
0-1 000 i/min |
Surfaces, mains, vêtements |
Fonctionnement sur ligne |
|
Personnel des installations |
|||
|
Détecteur pour mains et chaussures, de type G-M ou à scintillations |
Entre 1½ et 2 fois le rayonnement de fond |
Contrôle rapide de la contamination |
Fonctionnement automatique |
|
Applications spéciales |
|||
|
Détecteur pour la buanderie, les planchers, les portes et les véhicules |
Entre 1½ et 2 fois le rayonnement de fond |
Contrôle de la contamination |
Commode et rapide |
|
Détecteurs de surface α |
|||
|
Applications générales |
|||
|
Compteur proportionnel à air, portable avec sonde |
0-100 000 i/min |
Surfaces, mains, vêtements |
Ne pas utiliser sous forte humidité, alimentation par piles, fenêtre fragile |
|
Compteur portable à circulation de gaz avec sonde |
0-100 000 i/min |
Surfaces, mains, vêtements |
Alimentation par piles, fenêtre fragile |
|
Compteur portable à scintillations avec sonde |
0-100 000 i/min |
Surfaces, mains, vêtements |
Alimentation par piles, fenêtre fragile |
|
Usage personnel |
|||
|
Moniteur pour mains et chaussures de type compteur proportionnel |
0-2 000 i/min sur environ 300 cm2 |
Contrôle rapide de la contamination des mains et des chaussures |
Fonctionnement automatique |
|
Moniteur pour mains et chaussures de type compteur à scintillations |
0-4 000 i/min sur environ 300 cm2 |
Contrôle rapide de la contamination des mains et des chaussures |
Robuste |
|
Moniteur pour plaies |
Détection des photons à faible énergie |
Contrôle du plutonium |
Conception spéciale |
|
Contrôle de l’air |
|||
|
Appareils à prélèvements d’aérosols |
|||
|
A papier filtre, grand débit |
1,1 m3/min |
Echantillons ponctuels rapides |
Usage intermittent, nécessite un compteur distinct |
|
A papier filtre, petit débit |
0,2-20 m3/h |
Contrôle en continu de l’air ambiant |
Usage continu, nécessite un compteur distinct |
|
Modèle boutonnière |
0,03 m3/min |
Contrôle en continu de l’air respiré |
Usage continu, nécessite un compteur distinct |
|
Filtre électrostatique |
0,09 m3/min |
Contrôle en continu |
Dépôts recueillis sur boîtier cylindrique, nécessite un compteur distinct |
|
Impacteur |
0,6-1,1 m3/min |
Contamination alpha |
Applications spéciales, nécessite un compteur distinct |
|
Moniteurs de tritium |
|||
|
Chambre d’ionisation à courant gazeux |
0-370 kBq/m3/min |
Contrôle en continu |
Peut être sensible à d’autres sources d’ionisation |
|
Systèmes complets de contrôle de l’air |
Activité minimale détectable |
||
|
Papier filtre fixe |
α ~0,04 Bq/m3 βγ ~0,04 Bq/m3 |
Le niveau du rayonnement de fond peut masquer les faibles niveaux d’activité, compteur compris |
|
|
Papier filtre mobile |
α ~0,04 Bq/m3; βγ ~0,04 Bq/m3 |
Enregistrement en continu de l’activité de l’air, le moment de la mesure peut varier entre le moment de la collecte et n’importe quel moment ultérieur |
|
1 i/min = impulsions par minute.2 Les moniteurs de surface peuvent rarement détecter le tritium (3H). On recourt plutôt aux frottis et aux compteurs à scintillation liquide.3 G-M = compteur de Geiger-Müller.
La sensibilité d’un détecteur alpha dépend de la surface et de l’épaisseur de sa fenêtre. Celle-ci a généralement une surface de 50 cm2 ou plus et une masse surfacique de 1 mg/cm2 ou moins. Les détecteurs de contamination alpha devraient être insensibles au rayonnement bêta et gamma de façon à minimiser l’effet du rayonnement de fond. On leur donne en général cette caractéristique en intégrant un discriminateur d’amplitude d’impulsion dans leur circuit de comptage.
Les appareils alpha portables sont soit des compteurs proportionnels à gaz, soit des compteurs à scintillations au sulfure de zinc.
Divers appareils portables peuvent servir à la détection de la contamination bêta. Les compteurs de Geiger-Müller (G-M) ont ordinairement une fenêtre mince (masse surfacique comprise entre 1 et 40 mg/cm2). Les compteurs à scintillations (à anthracène ou à scintillateurs plastiques) sont très sensibles aux particules bêta et relativement insensibles aux photons. Les détecteurs bêta portables ne permettent généralement pas de détecter la contamination au tritium (3H) parce que, dans ce cas, les particules bêta émises sont à très faible énergie.
Tous les appareils utilisés pour détecter la contamination bêta réagissent également au rayonnement de fond. Il faut en tenir compte lorsqu’on interprète les lectures obtenues.
En présence de niveaux élevés de rayonnement de fond, les appareils portables sont d’une valeur limitée parce qu’ils ne peuvent pas indiquer de petites augmentations sur des taux de comptage élevés au départ. Il est recommandé dans ces cas de recourir aux contrôles par frottis.
Comme les émetteurs gamma émettent aussi des particules bêta, la plupart des détecteurs de contamination mesurent à la fois les rayons bêta et gamma. On se sert ordinairement d’appareils sensibles aux deux types de rayonnements ionisants afin d’obtenir une sensibilité accrue, car la détection des particules bêta est souvent plus efficace que celle des rayons gamma. Les scintillateurs plastiques et les cristaux d’iodure de sodium sont plus sensibles aux photons que les compteurs G-M et sont donc recommandés pour la détection des rayons gamma.
Le contrôle des aérosols contaminants de l’air se fait par prise d’échantillons qui sont ensuite soumis à l’une des méthodes suivantes: sédimentation, filtrage, impact et précipitation électrostatique ou thermique. Le filtrage est cependant la méthode la plus courante (l’air est pompé à travers un filtre dont on mesure ensuite la radioactivité). Les débits d’échantillonnage sont habituellement supérieurs à 0,03 m3/min; par contre, dans la plupart des laboratoires, ils ne dépassent pas 0,3 m3/min. Les échantillonneurs peuvent être de type intermittent ou continu. Les appareils à prélèvement d’air en continu sont équipés d’un papier filtre fixe ou mobile. Ils devraient comprendre une alarme, étant donné que leur principale fonction est de donner un avertissement en cas de changement sensible de la contamination de l’air ambiant.
Comme les particules alpha ont un parcours extrêmement court, des filtres de surface (comme les filtres à membrane) doivent être utilisés pour mesurer la contamination alpha. L’échantillon recueilli doit également être mince. Il faut tenir compte du laps de temps qui s’écoule entre la collecte et la mesure à cause de la désintégration des descendants du radon.
Les radio-isotopes de l’iode (123I,125I,131I) peuvent être détectés sur papier filtre (surtout si le papier est chargé de charbon de bois ou de nitrate d’argent), car une partie de l’iode se dépose sur le filtre. Toutefois, pour effectuer des mesures quantitatives, il est nécessaire de recourir à des filtres ou à des cartouches au charbon actif ou au zéolithe d’argent pour assurer une absorption efficace.
L’eau tritiée et le tritium gazeux sont les formes primaires de contamination au tritium. Même si l’eau tritiée a une certaine affinité avec la plupart des papiers filtres, ces derniers se prêtent mal à l’échantillonnage de l’eau tritiée. Les méthodes de mesure les plus sensibles et les plus précises se basent sur l’absorption d’un condensat de vapeur d’eau tritiée. Le tritium dans l’air (par exemple, sous forme d’hydrogène, d’hydrocarbure ou de vapeur d’eau) peut être mesuré efficacement à l’aide d’une chambre de Kanne (chambre d’ionisation en flux continu). L’absorption de la vapeur d’eau tritiée présente dans un échantillon d’air peut être réalisée en filtrant celui-ci sur un tamis moléculaire au gel de silice ou en le faisant barboter dans de l’eau distillée.
Selon l’opération ou le processus exécuté, il peut être nécessaire de contrôler les gaz radioactifs. Cela peut se faire au moyen de chambres de Kanne. Les dispositifs les plus couramment utilisés pour l’échantillonnage par absorption sont les laveurs de gaz et les impacteurs. Il est également possible de recueillir de nombreux gaz en abaissant la température de l’air au-dessous du point de congélation du gaz en question et en recueillant le condensat. Cette méthode est le plus souvent utilisée dans le cas de l’oxyde de tritium et des gaz rares.
Il existe plusieurs méthodes pour obtenir des échantillons ponctuels. La méthode choisie devrait être adaptée au gaz à détecter ainsi qu’à la méthode requise d’analyse ou de mesure.
Le contrôle des effluents consiste à en mesurer la radioactivité au point où ils sont rejetés dans l’environnement. Il est relativement facile à réaliser à cause de la nature contrôlée du point d’échantillonnage, habituellement situé dans un courant d’effluents rejetés par une cheminée ou une conduite.
Un contrôle continu de la radioactivité de l’air peut être nécessaire. En sus du dispositif de collecte, qui est ordinairement un filtre, on se sert en général d’un système de prélèvement de particules composé d’une pompe, d’un débitmètre et des conduites nécessaires. La pompe est placée en aval du dispositif de prélèvement pour que l’air passe d’abord par le filtre avant d’arriver dans le reste du système d’échantillonnage. Les conduites, surtout en amont du dispositif de prélèvement, devraient être aussi courtes que possible et exemptes de coudes et de zones de turbulence ou de résistance à l’écoulement de l’air. Le prélèvement de l’air devrait se faire à volume constant sur une plage suffisante de chute de pression. L’échantillonnage en continu destiné à détecter les radio-isotopes du xénon (Xe) ou du krypton (Kr) est réalisé par adsorption sur du charbon actif ou par cryogénie. Les ballons à scintillation (cellules de Lucas), qui représentent l’une des techniques les plus anciennes, demeurent le moyen le plus courant de mesurage des concentrations de radon. Ils sont maintenant remplacés par des détecteurs solides optiques de traces dans les mines.
Il est parfois nécessaire de contrôler en continu les liquides et les conduites d’évacuation pour détecter les matières radioactives. C’est le cas, par exemple, des conduites d’évacuation des laboratoires chauds et des laboratoires de médecine nucléaire, ainsi que des conduites du système caloporteur des réacteurs. Toutefois, le contrôle continu peut consister en une analyse périodique en laboratoire d’un petit échantillon proportionnel au débit d’effluents. Il existe des appareils pouvant prélever des parties aliquotes périodiques ou extraire en continu de petites quantités de liquide. Ils sont maintenant remplacés par des détecteurs solides optiques de traces dans les mines.
L’échantillonnage ponctuel est le plus courant lorsqu’il s’agit de déterminer la concentration de matières radioactives dans des réservoirs de rétention. L’échantillon doit être prélevé après recirculation pour qu’il soit possible de comparer le résultat aux taux de rejet admissibles.
Théoriquement, les résultats du contrôle des effluents devraient être en harmonie avec ceux du contrôle de l’environnement, les seconds devant pouvoir être déduits des premiers à l’aide de différents modèles. Toutefois, il faut reconnaître que le contrôle des effluents, si efficace et complet qu’il soit, ne peut pas se substituer à des mesures réelles de radioactivité de l’environnement.
Cet article décrit quelques aspects des programmes de protection radiologique. L’objet de la radioprotection est d’éliminer ou de minimiser les effets nocifs des rayonnements ionisants et des matières radioactives sur les travailleurs, le public et l’environnement, tout en profitant de leurs applications bénéfiques.
La plupart des programmes de radioprotection n’auront pas à inclure chacun des éléments décrits ci-dessous, la conception de chacun dépendant du type de rayonnements ionisants en cause et de la façon dont ils sont utilisés.
La Commission internationale de protection radiologique (CIPR) a proposé que l’utilisation des rayonnements ionisants et l’application des normes de sécurité radiologique se fondent sur les principes suivants:
Il existe des normes d’exposition aux rayonnements pour les travailleurs et le public ainsi que des normes portant sur les limites annuelles d’incorporation (LAI) de radionucléides. Des normes relatives aux concentrations de radionucléides dans l’air et dans l’eau peuvent être calculées à partir des LAI.
La Commission internationale de protection radiologique (CIPR) a publié des listes complètes de LAI et de concentrations correspondantes de radionucléides dans l’air et dans l’eau. Un résumé des limites de dose recommandées figure dans le tableau 48.15.
|
Application |
Limite de dose |
|
|
Travailleurs |
Public |
|
|
Dose efficace |
20 mSv par an, moyenne sur 5 années consécutives2 |
1 mSv par an3 |
|
Equivalent de dose annuel pour différents organes et tissus |
||
|
Cristallin |
150 mSv |
15 mSv |
|
Peau4 |
500 mSv |
50 mSv |
|
Mains et pieds |
500 mSv |
|
1 Les limites s’appliquent à la somme des doses applicables provenant de sources externes durant la période indiquée, et de la dose engagée sur 50 ans (jusqu’à 70 ans pour les enfants) incorporée pendant la même période.2 En outre, la dose efficace ne doit pas dépasser 50 mSv pour une année donnée. D’autres restrictions s’appliquent à l’exposition professionnelle des femmes enceintes. 3 Dans des circonstances particulières, on peut admettre une dose efficace supérieure pour une année donnée, pourvu que la moyenne sur 5 ans ne dépasse pas 1 mSv par an.4 La limite de la dose efficace suffit pour protéger la peau contre les effets stochastiques. Une limite supplémentaire est nécessaire pour les expositions localisées afin de prévenir les effets déterministes.
La dosimétrie permet de déterminer les équivalents de dose que les travailleurs reçoivent par suite de l’exposition subie dans des zones d’irradiation externe . Les dosimètres se distinguent par le type du dispositif, le genre de rayonnement qu’il est conçu pour mesurer et la partie du corps pour laquelle la dose absorbée doit être indiquée.
Trois principaux types d’appareils sont d’un usage courant: les dosimètres thermoluminescents, les dosimètres à film et les chambres d’ionisation. Parmi les autres types (que nous n’examinons pas ici), il y a lieu de signaler les détecteurs solides de trace à fission («fission foil»), de traces («track-etch») et à bulle plastique («plastic bubble») d’Apfel (dosimètre individuel).
Les dosimètres thermoluminescents sont les plus courants des dosimètres individuels. Ils tirent parti du fait que certaines substances ayant absorbé l’énergie de rayonnements ionisants peuvent la conserver pour la restituer plus tard sous forme de lumière lorsqu’elles sont chauffées. La quantité de lumière émise est, dans une grande mesure, directement proportionnelle à l’énergie absorbée provenant du rayonnement ionisant et, par conséquent, à la dose absorbée par la substance. Cette proportionnalité se maintient sur une très large plage d’énergie et de débit de dose absorbée.
Un équipement spécial est nécessaire pour traiter les dosimètres thermoluminescents parce que la lecture détruit l’information qu’ils contiennent. Par contre, un traitement approprié permet de s’en servir à nouveau.
Les substances utilisées dans ces dosimètres doivent être transparentes à la lumière qu’elles émettent. Les plus courantes sont le fluorure de lithium (Fli) et le fluorure de calcium (F2Ca), qui sont parfois dopés ou dotés d’une composition isotopique précise pour servir à des fins particulières, comme la dosimétrie des neutrons.
Beaucoup de dosimètres comportent plusieurs pastilles thermoluminescentes associées chacune à un filtre différent permettant de distinguer divers types de rayonnement et valeurs d’énergie.
Les dosimètres à film étaient les plus courants parmi les appareils destinés au personnel avant l’arrivée des dosimètres thermoluminescents. Le degré de noircissement de la pellicule dépend de l’énergie ionisante absorbée, mais la relation n’est pas linéaire. La réaction de la pellicule dépend davantage de la dose totale absorbée, du débit de dose absorbée et de l’énergie de rayonnement que dans le cas des dosimètres thermoluminescents, ce qui en limite le champ d’application. Cependant, le dosimètre à film a l’avantage de produire une preuve permanente de la dose absorbée à laquelle il a été exposé.
On peut recourir à diverses émulsions photographiques et à différentes gammes de filtres à des fins particulières, telles que la dosimétrie des neutrons. Comme dans le cas des dosimètres thermoluminescents, un équipement spécial est nécessaire pour effectuer correctement les analyses.
La pellicule photographique est en général beaucoup plus sensible à l’humidité et à la température ambiantes que les substances thermoluminescentes et peut donc donner des lectures faussement élevées dans des conditions défavorables. D’un autre côté, les équivalents de dose indiqués par les dosimètres thermoluminescents peuvent être faussés par un choc, par exemple si on les laisse tomber sur une surface dure.
Seuls les plus grands établissements ont leurs propres services de dosimétrie. La plupart des autres obtiennent ces services en s’adressant à des entreprises spécialisées. Il importe alors de s’assurer que ces entreprises sont autorisées ou accréditées par une autorité indépendante d’une compétence reconnue.
Des petites chambres d’ionisation à lecture directe, appelées «chambres de poche», servent à obtenir une information dosimétrique immédiate, notamment lorsque des travailleurs doivent entrer dans des zones hautement ou très hautement radioactives où ils peuvent recevoir d’importantes doses absorbées en un court laps de temps. Les chambres de poche sont souvent étalonnées sur place. Comme elles sont très sensibles aux chocs, il faudrait toujours les utiliser en sus de dosimètres thermoluminescents ou à film, qui sont plus précis et sûrs, mais ne donnent pas d’indications immédiates.
La dosimétrie est nécessaire lorsqu’un travailleur a une probabilité raisonnable d’accumuler un certain pourcentage, d’ordinaire 5 à 10%, de l’équivalent de dose maximale admissible pour le corps entier ou certaines parties du corps.
Un dosimètre pour le corps entier doit être porté entre les épaules et la taille, au point que l’on pense être le plus fortement exposé. Si les conditions d’exposition le justifient, le travailleur peut être équipé d’autres dosimètres aux doigts ou au poignet, au niveau de l’abdomen, sur une coiffe ou un bandeau porté au front ou encore sur un collier, afin d’évaluer l’exposition localisée des extrémités, celle d’un fœtus ou d’un embryon, ou celle de la thyroïde ou du cristallin. La réglementation applicable précise s’il faut porter les dosimètres du côté intérieur ou extérieur de vêtements protecteurs tels que tabliers, gants et protège-thyroïde au plomb.
Les dosimètres destinés au personnel ne mesurent que le rayonnement auquel les appareils eux-mêmes sont soumis. Il n’est acceptable d’assimiler l’équivalent de dose du dosimètre à celui d’une personne ou d’un organe que si les doses en cause sont petites ou négligeables. Des lectures élevées, surtout si elles dépassent largement les normes réglementaires, doivent être soigneusement analysées, en tenant compte de la position du dosimètre et des champs de rayonnement réels auxquels le travailleur a été exposé, pour estimer la dose réelle que celui-ci a reçue. Il importe dans ces cas d’obtenir une déclaration du travailleur et de la porter au dossier dans le cadre de l’enquête. Toutefois, les valeurs indiquées très élevées sont le plus souvent dues à une exposition délibérée du dosimètre sans que la personne ne le porte à ce moment.
Les analyses biologiques ou radiobiologiques consistent à déterminer le genre, la quantité ou la concentration et, parfois, l’emplacement de substances radioactives dans l’organisme soit par mesure directe (comptage in vivo), soit par analyse et évaluation de matériaux d’excreta ou d’échantillons prélevés sur le sujet.
Les analyses biologiques visent en général à évaluer l’équivalent de dose reçu par un travailleur par suite de l’ingestion ou de l’inhalation d’une matière radioactive. Elles permettent également de juger l’efficacité de mesures concrètes prises pour prévenir l’incorporation de telles matières. On y recourt aussi à l’occasion pour estimer la dose qu’un travailleur a reçue par suite d’une irradiation externe massive (par exemple, par numération des globules blancs ou examen des anomalies chromosomiques).
Des examens biologiques sont nécessaires si un travailleur a des chances raisonnables d’avoir reçu ou de retenir dans son organisme plus qu’un certain pourcentage (d’ordinaire 5 ou 10%) de la LAI d’un radionucléide. La forme physique et chimique du radionucléide recherché détermine la nature du test nécessaire pour le déceler.
Le dosage radiobiologique peut consister à analyser des échantillons (urines, fèces, sang ou cheveux) pour y rechercher des radio-isotopes. Dans ce cas, sur la base de la radioactivité du prélèvement, on peut évaluer la radioactivité présente dans l’organisme de la personne et, par conséquent, la dose de rayonnement reçue ou engagée pour le corps ou pour certains organes. Un biodosage du tritium dans l’urine est un exemple d’analyse de ce genre.
Diverses techniques d’imagerie médicale appliquées à tout le corps ou à certains organes peuvent servir à déceler les radionucléides émetteurs de rayons X ou gamma d’une énergie mesurable à l’extérieur du corps. La détection de l’iode 131 (131I) dans la glande thyroïde est un exemple d’analyse de ce genre.
On peut effectuer les analyses sur place ou envoyer les échantillons ou le personnel en cause dans un laboratoire spécialisé. Dans les deux cas, un étalonnage adéquat de l’équipement et l’agrément des méthodes utilisées sont essentiels pour garantir l’obtention de résultats exacts, précis et non contestables (au sens médico-légal).
L’employeur fournit des équipements de protection pour réduire la possibilité de contamination radioactive des travailleurs et de leurs vêtements (vêtements, gants, capuchons et bottes anticontamination) et pour atténuer l’intensité des rayonnements bêta, X et gamma auxquels ils sont exposés (tabliers, gants et lunettes plombés).
Un dispositif de protection respiratoire est un appareil servant à réduire l’inhalation de poussières radioactives en aérosols dans l’air.
Dans la mesure du possible, les employeurs doivent recourir à des procédés industriels appropriés ou à d’autres moyens de prévention technique (par exemple, confinement ou ventilation) pour limiter la teneur de l’air en poussières radioactives. S’il est impossible de ramener par ces moyens la concentration des matières radioactives dans l’air en deçà de la valeur à laquelle une zone est dite radioactive, l’employeur doit, conformément à son obligation de maintenir l’équivalent total de dose efficace au niveau le plus bas (principe ALARA) que l’on puisse raisonnablement atteindre, renforcer la surveillance de l’air ambiant et limiter l’inhalation des matières radioactives en appliquant un ou plusieurs des moyens suivants:
L’équipement de protection respiratoire fourni aux travailleurs doit être conforme aux normes nationales applicables à ce genre d’appareils.
L’employeur doit établir et mettre en œuvre un programme de protection respiratoire comprenant les éléments suivants:
L’employeur doit avertir chaque utilisateur d’appareil respiratoire qu’il est autorisé à quitter les lieux de travail à tout moment pour enlever son masque, en cas de défaillance technique, de détresse physique ou psychologique, de manquement aux procédures ou de rupture des communications, de dégradation sensible des conditions de fonctionnement ou d’autre situation pouvant nécessiter l’enlèvement du masque.
Même si les circonstances n’imposent pas le port régulier d’appareils de protection respiratoire, le risque d’urgences raisonnablement prévisibles peut imposer de les avoir sur place. Dans de tels cas, ceux-ci doivent également être agréés pour l’utilisation prévue par un organisme d’agrément compétent et être constamment maintenus en état de servir.
Les travailleurs exposés à des rayonnements ionisants devraient disposer de services de santé similaires à ceux des travailleurs exposés à d’autres types de risques professionnels.
Des examens généraux préalables à l’embauche permettent d’évaluer l’état de santé du candidat et d’établir des données de base. Il importe de toujours obtenir les antécédents médicaux et les antécédents d’exposition. Des examens spécialisés (par exemple, examen du cristallin et numération globulaire) peuvent être nécessaires selon la nature de l’exposition prévue. La décision à cet égard devrait être laissée au médecin traitant.
Un contrôle de contamination est une évaluation des conditions radiologiques qui entourent la production, l’utilisation, le rejet, l’élimination ou la présence de substances radioactives ou d’autres sources de rayonnement. Il peut comprendre, s’il y a lieu, un contrôle physique du lieu où sont conservées des sources radioactives ainsi que la mesure ou le calcul des niveaux de rayonnement ou des concentrations ou quantités de matières radioactives présentes.
Les contrôles de contamination permettent de prouver la conformité aux règlements nationaux et d’évaluer les niveaux de rayonnement, les concentrations ou les quantités de matières radioactives et les risques radiologiques qui peuvent exister.
Leur fréquence est dictée par l’importance du risque d’irradiation. Les zones d’entreposage de déchets radioactifs devraient faire l’objet de contrôles hebdomadaires, de même que les laboratoires et les cliniques où sont couramment manipulées des sources radioactives non scellées. Des contrôles mensuels devraient suffire dans les établissements qui ne travaillent que sur de petites quantités de matières radioactives, comme ceux qui effectuent des essais in vitro à l’aide de radio-isotopes tels que le tritium (3H), le carbone 14 (14C) et l’iode 125 (125I), dont l’activité est inférieure à quelques kBq.
L’équipement de radioprotection et les appareils de contrôle radiologique doivent convenir aux types de substances radioactives et de rayonnements en cause et doivent être correctement étalonnés.
Les contrôles de contamination comprennent des mesures des niveaux de rayonnement ambiants à l’aide de compteurs Geiger-Müller (G-M), de chambres d’ionisation ou de compteurs à scintillation; des mesures de la contamination superficielle de type α ou βγ à l’aide de compteurs G-M à fenêtre mince ou de compteurs à scintillation au sulfure de zinc (ZnS); des contrôles des surfaces par frottis analysés par la suite à l’aide de compteurs à scintillation multicanaux à l’iodure de sodium (NaI), de compteurs au germanium (Ge) ou de compteurs à scintillation liquide, selon le cas.
Des niveaux appropriés d’intervention doivent être établis pour les rayonnements ambiants et la contamination. Dès qu’un niveau d’intervention est dépassé, des mesures doivent immédiatement être prises pour ramener les niveaux détectés à des valeurs acceptables et prévenir toute exposition inutile du personnel ainsi que toute absorption ou propagation de matières radioactives.
Le contrôle environnemental comprend la collecte d’échantillons ambiants pour en mesurer la concentration en matières radioactives et le contrôle des niveaux de rayonnement à l’extérieur des lieux de travail et aux alentours. Il a pour objet d’estimer les conséquences pour les humains du rejet de radionucléides dans la biosphère, de déceler les fuites de matières radioactives dans l’environnement avant qu’elles ne deviennent graves et de prouver la conformité à la réglementation.
Une description complète des techniques de contrôle de l’environnement déborde le cadre de cet article. Nous en examinerons cependant les principes généraux.
Des échantillons ambiants doivent être prélevés pour contrôler les voies les plus probables par lesquelles les radionucléides peuvent passer de l’environnement à l’organisme humain. Il faudrait, par exemple, prélever périodiquement des échantillons de terre, d’eau, d’herbe et de lait dans les régions agricoles entourant une centrale nucléaire pour déterminer leur concentration en iode 131 (131I) et en strontium 90 (90Sr).
Le contrôle de l’environnement peut comprendre le prélèvement d’échantillons d’air, d’eaux souterraines, d’eaux de surface, de sol, de feuillage, de poisson, de lait, d’animaux sauvages, etc. Le choix des échantillons et de la fréquence de prélèvement devrait se baser sur les objectifs du contrôle, quoique le prélèvement au hasard d’un petit nombre d’échantillons puisse parfois révéler des problèmes jusqu’alors non perçus.
La première étape de l’élaboration d’un programme de contrôle de l’environnement consiste à déterminer le type, la quantité et les caractéristiques physiques et chimiques des radionucléides rejetés ou pouvant être accidentellement rejetés.
Il faut ensuite évaluer les possibilités de propagation de ces radionucléides par voie aérienne ou par les eaux souterraines ou de surface, afin de prédire les concentrations pouvant atteindre les êtres humains directement par l’air et l’eau, ou indirectement par la chaîne alimentaire.
L’étape suivante porte sur la bioaccumulation de radionucléides résultant des rejets dans l’environnement aquatique et terrestre. Il s’agit dans ce cas de prédire la concentration des radionucléides une fois qu’ils sont passés dans la chaîne alimentaire.
Finalement, on examine le taux de consommation des produits alimentaires susceptibles d’être contaminés, la contribution de cette consommation à la dose de rayonnement absorbée et les risques correspondants pour la santé. Les résultats de cette analyse permettent de déterminer la meilleure démarche à adopter quant au prélèvement d’échantillons environnementaux et de s’assurer que ce programme de contrôle atteint ses objectifs.
Une source scellée est constituée d’une substance radioactive enfermée dans une capsule conçue pour empêcher toute fuite. Les sources scellées doivent périodiquement faire l’objet d’un contrôle d’étanchéité.
Chaque source scellée doit être soumise à un contrôle d’étanchéité avant d’être utilisée pour la première fois, à moins que le fournisseur n’ait produit un certificat attestant qu’elle a été testée dans les six mois (trois mois dans le cas des émetteurs α), avant remise au destinataire. Chaque source scellée doit ensuite faire l’objet d’un contrôle d’étanchéité au moins une fois tous les six mois (trois mois dans le cas des émetteurs α), ou à la fréquence prescrite par règlement.
D’une façon générale, les sources qui suivent n’ont pas à être soumises à des essais d’étanchéité:
Le personnel de radioprotection doit tenir un inventaire à jour des matières radioactives et des autres sources de rayonnements ionisants dont l’établissement est responsable (en France par exemple, c’est le Service de protection contre les rayonnements (SPR) ou la personne compétente pour un petit établissement). Les procédures internes doivent garantir que ce personnel est tenu au courant de la réception, de l’utilisation, du transfert et de l’élimination de toutes ces matières et sources pour que l’inventaire puisse être tenu à jour. Un inventaire physique de toutes les sources scellées devrait être établi au moins une fois tous les trois mois. Les stocks de sources de rayonnements ionisants devraient être contrôlés dans le cadre de la vérification annuelle du programme de sécurité radiologique.
La figure 48.19 présente le symbole international normalisé des rayonnements ionisants. Ce symbole doit figurer en bonne place sur toute la signalisation indiquant les zones contrôlées pour fins de radioprotection et sur les étiquettes des conteneurs renfermant des matières radioactives.
Les zones contrôlées pour fins de radioprotection sont souvent classées en fonction de niveaux croissants de débits de dose. Elles doivent être signalées par un ou plusieurs panneaux ou affiches bien en vue portant le symbole des rayonnements et l’avertissement «ATTENTION, ZONE DE RAYONNEMENT», «ATTENTION [ou DANGER], ZONE DE HAUT RAYONNEMENT» ou «GRAVE DANGER, ZONE DE TRÈS HAUT RAYONNEMENT», selon le cas. Dans la réglementation de l’Union européenne, les titres et définitions peuvent différer très légèrement, tout en étant conformes dans l’esprit.
Si une zone ou un local contiennent une quantité appréciable de matières radioactives (selon la définition de l’autorité de réglementation), un panneau portant le symbole des rayonnements et le message «ATTENTION [ou DANGER], MATIÈRES RADIOACTIVES» doit être placé bien en vue à l’entrée de la zone ou du local.
Une zone de radioactivité ambiante est une zone ou un local où la radioactivité des contaminants en suspension dans l’air dépasse certains niveaux définis par l’autorité de réglementation. Une telle zone doit être signalée par un ou plusieurs panneaux bien en vue portant le symbole des rayonnements et le message «ATTENTION [ou DANGER], ZONE DE RADIOACTIVITÉ AMBIANTE».
On peut exempter de ces exigences de signalisation les chambres de malades dans les hôpitaux, pourvu qu’elles soient par ailleurs soumises à un contrôle adéquat. Peuvent être également exemptés les zones ou locaux où les sources de rayonnement ne seront présentes que pendant des périodes de huit heures ou moins, sous la surveillance et le contrôle constants de membres compétents du personnel.
Le degré de contrôle de l’accès auquel une zone est soumise dépend du risque d’exposition à des rayonnements ionisants.
Chaque entrée ou point d’accès d’une zone de haut rayonnement doit avoir une ou plusieurs des caractéristiques suivantes:
Une surveillance directe ou électronique constante permettant de prévenir l’entrée de personnes non autorisées peut être substituée aux dispositifs de contrôle exigés pour les zones de haut rayonnement.
Les systèmes de contrôle doivent être conçus de façon à ne pas empêcher de ressortir d’une zone de haut rayonnement une personne qui y est entrée.
En sus des exigences applicables aux zones de haut rayonnement, d’autres mesures doivent être prises pour interdire l’entrée sans autorisation ou par inadvertance dans des zones où il est possible de recevoir une dose absorbée de 5 Gy ou plus en 1 h à 1 m d’une source de rayonnement ou d’une surface que le rayonnement traverse.
Tout conteneur renfermant une quantité de matières radioactives dépassant la valeur définie par l’autorité de réglementation doit porter bien en évidence une étiquette durable mentionnant le symbole de rayonnement et le message «ATTENTION, MATIÈRES RADIOACTIVES» ou «DANGER, MATIÈRES RADIOACTIVES». L’étiquette doit également contenir suffisamment de renseignements — radionucléides présents, estimation de la quantité de radioactivité, date à laquelle l’activité a été estimée, niveau de rayonnement, type de substances et enrichissement — pour permettre à des personnes devant manipuler ou utiliser les conteneurs ou travailler à proximité de prendre les précautions nécessaires afin d’éviter ou de minimiser l’exposition.
Avant d’enlever ou de mettre au rebut des conteneurs vides non contaminés dans des zones non contrôlées, on doit enlever ou invalider les étiquettes signalant la présence de matières radioactives ou indiquer clairement d’une autre façon que les conteneurs ne renferment plus de matières radioactives.
Les étiquettes ne sont pas nécessaires:
Les zones de haut rayonnement et de très haut rayonnement doivent être équipées de dispositifs avertisseurs et d’alarmes, comme nous l’avons mentionné plus haut. Ces dispositifs peuvent émettre un signal visuel, sonore ou les deux. Dans le cas des installations telles que les accélérateurs de particules, ils devraient être automatiquement mis sous tension dans le cadre de la procédure de mise en marche, de façon que le personnel ait le temps d’évacuer les lieux ou d’interrompre le fonctionnement de l’installation à l’aide d’un bouton d’arrêt d’urgence avant que des rayonnements ne soient émis. Les boutons d’arrêt d’urgence (ces boutons, placés dans la zone contrôlée, lorsqu’ils sont actionnés, font immédiatement baisser le niveau de rayonnement à une valeur non dangereuse) doivent être faciles d’accès, être bien en vue et porter des marques qui attirent l’attention.
Les dispositifs de contrôle tels que les appareils à prélèvement d’air en continu peuvent être préréglés pour émettre un signal sonore et visuel ou pour arrêter l’installation dès qu’un niveau d’intervention donné est dépassé.
L’employeur doit mettre à la disposition des travailleurs des appareils de mesure adéquats convenant aux niveaux et aux types de rayonnement et de matières radioactives présents sur les lieux de travail. Ces moniteurs peuvent servir à détecter, à contrôler ou à mesurer les niveaux de rayonnement ou de radioactivité.
Les appareils de mesure doivent être étalonnés à intervalles appropriés par des méthodes et avec des sources d’étalonnage agréées. Les sources d’étalonnage devraient être aussi semblables que possible aux sources à détecter ou à mesurer.
Les appareils en question comprennent les compteurs portables, les moniteurs d’air en continu, les moniteurs pour les mains et les pieds installés à l’entrée des zones contrôlées, les compteurs à scintillation liquide, les détecteurs à cristaux de germanium (Ge) ou d’iodure de sodium (Nal), etc.
L’Agence internationale de l’énergie atomique (AIEA) a publié un règlement régissant le transport des matières radioactives, dont la plupart des pays se sont inspirés pour établir leurs propres règlements.
Les figures 48.20 à 48.22 montrent des exemples d’étiquettes que le règlement de l’AIEA prescrit d’apposer sur les colis devant servir à l’expédition de matières radioactives. L’indice de transport figurant sur les étiquettes des figures 48.21 et 48.22 désigne le débit de dose efficace le plus élevé qu’on puisse mesurer à 1 m de n’importe quelle surface du colis, exprimé en mSv/h, multiplié par 100 et arrondi au dixième le plus proche (par exemple, si le débit de dose le plus élevé à 1 m est de 0,0233 mSv/h, l’indice de transport est égal à 2,4).


La figure 48.23 montre un exemple de plaque que les véhicules de transport en surface doivent porter bien en évidence lorsqu’ils transportent des colis contenant une quantité de matières radioactives dont l’activité dépasse un certain seuil.
Les emballages devant servir à l’expédition de matières radioactives doivent être conformes à des exigences strictes d’épreuve et de documentation. Le type et la quantité de matières radioactives expédiées déterminent les spécifications auxquelles doit satisfaire l’emballage.
La réglementation du transport des matières radioactives est complexe. Les personnes qui ne s’en occupent pas régulièrement devraient toujours consulter des spécialistes de ce domaine.
Il y a différentes méthodes d’élimination des déchets radioactifs, mais elles sont toutes soumises au contrôle des autorités de réglementation. Par conséquent, les établissements doivent toujours consulter l’autorité de réglementation dont ils relèvent pour vérifier si une méthode d’élimination est admissible. Ces méthodes comprennent le stockage pour élimination ultérieure après décroissance radioactive en tant que déchet banal, l’incinération, le rejet dans le réseau d’égouts, l’enfouissement souterrain et l’immersion à grande profondeur. Nous n’examinerons pas cette dernière méthode, souvent interdite par les lois nationales et les traités internationaux.
Les déchets radioactifs provenant du cœur des réacteurs (déchets à haute activité) posent des problèmes particuliers. Leur manipulation et leur élimination sont contrôlées par les organismes de réglementation nationaux et internationaux.
Souvent, les déchets radioactifs peuvent avoir des caractéristiques autres que la radioactivité qui les rendent par elles-mêmes dangereux. Ce sont les déchets mixtes (par exemple, déchets radioactifs qui sont en même temps toxiques ou comportent des risques biologiques). Les déchets mixtes nécessitent une manipulation spéciale. Il est donc essentiel de consulter les autorités de réglementation avant de les éliminer.
Si la période d’une substance radioactive est courte (en général, moins de 65 jours) et que l’établissement dispose de locaux de stockage assez vastes, les déchets contenant cette substance peuvent être entreposés jusqu’à ce que leur radioactivité soit suffisamment atténuée pour que l’on puisse les éliminer sans tenir compte de leur radioactivité. Une période de conservation correspondant au moins à dix périodes radioactives est jugée suffisante pour abaisser le niveau d’activité des déchets à une valeur qui n’est pas supérieure au niveau naturel de radioactivité.
Avant élimination, les déchets doivent être contrôlés à l’aide d’appareils de mesure convenant au rayonnement à détecter. Le contrôle doit établir que le niveau de rayonnement des déchets ne dépasse pas le niveau de rayonnement naturel.
Si l’autorité de réglementation autorise l’incinération, il faut ordinairement démontrer qu’elle ne fait pas monter la concentration atmosphérique de radionucléides au-delà des niveaux admissibles. On doit contrôler périodiquement les cendres pour s’assurer qu’elles ne sont pas radioactives. Il peut être nécessaire, dans certaines circonstances, de contrôler les gaz rejetés par la cheminée pour vérifier que les concentrations admissibles dans l’air ne sont pas dépassées.
Si l’autorité de réglementation permet ce rejet, il faut ordinairement démontrer qu’il n’élève pas la concentration de radionucléides dans l’eau au-delà des niveaux admissibles. Les matières à éliminer doivent être solubles ou pouvoir facilement se disperser dans l’eau. L’autorité de réglementation fixe souvent des limites annuelles précises de rejet par radionucléide.
Les déchets radioactifs qu’il est impossible d’éliminer par d’autres moyens sont enfouis dans des sites autorisés par les autorités de réglementation locales ou nationales. Ces autorités exercent en général un contrôle étroit sur cette forme d’élimination. Les producteurs de déchets ne sont pas ordinairement autorisés à enfouir des déchets radioactifs sur leurs propres terrains. Aux frais d’enfouissement proprement dits s’ajoutent donc des frais d’emballage, d’expédition et d’entreposage. Comme ils sont basés sur l’espace occupé, les frais d’enfouissement peuvent souvent être réduits par compactage des déchets. Le coût de l’enfouissement des déchets radioactifs est en train d’augmenter rapidement.
Les programmes et consignes de sécurité radiologique devraient faire l’objet de vérifications périodiques destinées à s’assurer qu’ils restent efficaces, complets et conformes aux règles de l’autorité de réglementation. La vérification devrait se faire au moins une fois par an et être complète. Les autovérifications sont en principe acceptées, mais il est préférable de s’adresser à des organismes extérieurs indépendants. Les vérifications externes sont généralement plus objectives et reflètent un point de vue plus global que les vérifications locales. Un organisme de vérification qui n’a rien à voir avec les opérations quotidiennes reliées à un programme de sécurité radiologique peut souvent mettre en lumière des problèmes non perçus par les exploitants locaux, parce qu’ils se sont habitués à les négliger.
Les employeurs doivent donner une formation en radioprotection à tous les travailleurs exposés ou pouvant être exposés à des rayonnements ionisants ou à des matières radioactives. Ils doivent offrir une formation initiale avant que les travailleurs ne commencent à exercer leurs fonctions, puis des cours de recyclage annuels. De plus, les femmes en âge de procréer doivent recevoir une formation spéciale et être informées au sujet des effets des rayonnements ionisants sur l’embryon et le fœtus et des précautions à prendre à cet égard. Cette formation spéciale doit leur être dispensée à leur entrée en fonctions, lors des cours de recyclage annuels, ainsi que dès qu’elles informent leur employeur qu’elles sont enceintes.
Toute personne qui travaille ou séjourne fréquemment dans une partie quelconque d’une zone dont l’accès est contrôlé aux fins de la radioprotection doit:
L’importance de la formation et des instructions en radioprotection doit correspondre aux risques que la présence dans la zone contrôlée fait courir aux travailleurs. Formation et instructions devraient, au besoin, s’étendre au personnel auxiliaire (par exemple, infirmières chargées de soigner les patients exposés à la radioactivité dans les hôpitaux ainsi que sapeurs-pompiers et agents de police pouvant être appelés à intervenir en cas d’urgence).
Les employeurs doivent s’assurer que les travailleurs exposés à des rayonnements ionisants ont la compétence nécessaire pour exercer leurs fonctions. Ils doivent avoir les antécédents et l’expérience voulus pour faire leur travail en toute sécurité, particulièrement en ce qui a trait à l’exposition aux rayonnements ionisants et aux substances radioactives et à leur utilisation.
Le personnel de radioprotection doit avoir les connaissances et les qualifications nécessaires pour mettre en œuvre et exploiter un programme efficace de sécurité radiologique. Connaissances et qualifications doivent au moins correspondre à la gravité des problèmes de radioprotection que les membres du personnel sont raisonnablement susceptibles de rencontrer.
Tous les organismes qui utilisent des rayonnements ionisants ou des matières radioactives, sauf les plus petits, doivent avoir des plans d’urgence, qu’ils doivent tenir à jour et tester périodiquement au cours d’exercices.
Les plans d’urgence devraient prévoir toutes les situations d’urgence vraisemblables. Bien sûr, ceux d’une grande centrale nucléaire devront être plus importants, porter sur une plus grande zone et faire intervenir un plus grand nombre de personnes que ceux d’un petit laboratoire de radio-isotopes.
Tous les hôpitaux, surtout dans les grandes agglomérations urbaines, devraient avoir des plans d’admission et de traitement de patients victimes de contamination radioactive. La police et les services d’incendie devraient également avoir des plans pour faire face aux accidents pouvant survenir au cours du transport de matières radioactives.
Les activités de radioprotection d’un organisme doivent faire l’objet d’une documentation complète qu’il conviendrait de conserver pendant une période appropriée. Une telle documentation est essentielle pour établir des antécédents d’exposition ou de rejet de matières radioactives et pour démontrer la conformité aux exigences de l’autorité de réglementation. La tenue de dossiers cohérents, exacts et complets devrait être considérée comme hautement prioritaire.
Le premier responsable de la radioprotection doit occuper dans l’établissement un poste lui donnant un accès immédiat à tous les échelons de travailleurs et de cadres. Il doit pouvoir entrer librement dans les zones contrôlées aux fins de la radioprotection et avoir l’autorité nécessaire pour faire cesser immédiatement toute pratique qu’il juge dangereuse ou illégale.
Cet article présente un compte rendu de plusieurs accidents importants dus aux rayonnements, leurs causes et les réactions qu’ils ont suscitées. Les planificateurs trouveront sans doute dans l’examen des événements qui ont précédé, marqué et suivi ces accidents des renseignements susceptibles de leur permettre d’éviter que de tels accidents se répètent et de réagir mieux et plus rapidement s’ils devaient se produire à nouveau.
Cet accident est particulièrement notable parce qu’il a entraîné la plus forte dose de rayonnement qui ait jamais été accidentellement reçue par des humains (jusqu’ici) et qu’il a fait l’objet d’une analyse extrêmement professionnelle et approfondie. Il s’agit en fait de l’un des cas les mieux documentés de syndrome aigu d’irradiation (JOM, 1961).
Le 30 décembre 1958, à 16 h 35, à la suite d’une excursion critique accidentelle, un employé (K) de l’usine de récupération de plutonium du Los Alamos National Laboratory (Nouveau-Mexique, Etats-Unis) a reçu une dose mortelle de rayonnements.
L’heure de l’accident est importante parce que six autres travailleurs se trouvaient dans la même pièce en compagnie de K trente minutes plus tôt. La date de l’accident est également importante parce que l’alimentation normale du système en matières fissiles avait été interrompue pour l’inventaire physique de fin d’année. A cause de l’interruption, la procédure habituelle n’avait pas été suivie, ce qui a entraîné un accident de criticité dans des substances solides riches en plutonium accidentellement introduites dans le système.
La meilleure approximation obtenue de l’exposition moyenne sur tout le corps entier de K se situait entre 39 et 49 Gy, dont environ 9 Gy étaient attribuables à des neutrons de fission. La moitié supérieure du corps de K avait reçu une proportion beaucoup plus grande de rayonnements que la moitié inférieure. Le tableau 48.16 présente une estimation de l’exposition.
|
Partie du corps et conditions |
Dose absorbée de neutrons rapides (Gy) |
Dose absorbée de rayons gamma (Gy) |
Dose absorbée totale (Gy) |
|
Tête (rayonnement incident) |
|
|
|
|
Partie supérieure de l’abdomen (rayonnement incident) |
|
|
|
|
Corps entier (moyenne) |
9 |
30-40 |
39-49 |
Il est possible, rétrospectivement, de subdiviser l’évolution clinique de K en quatre périodes distinctes, différentes les unes des autres par leur durée, les symptômes et la réaction de K à la thérapeutique.
La première période, qui a duré 20 à 30 minutes, s’est caractérisée par un effondrement physique et une incapacité mentale immédiats. La situation de K a évolué vers un état de semi-conscience et une grave prostration.
La deuxième période a duré près de 90 minutes. Elle a commencé avec l’arrivée de K sur une civière, dans la salle des urgences de l’hôpital et s’est terminée par son transfert dans une chambre. Cet intervalle a été marqué par un tel état de choc cardio-vasculaire que la mort a semblé imminente pendant toute la période. K semblait également souffrir de graves douleurs abdominales.
La troisième période a duré environ 28 heures. Elle s’est caractérisée par une amélioration subjective suffisante de l’état du patient pour encourager le personnel médical à poursuivre les tentatives destinées à combattre l’anoxie, l’hypotension et l’insuffisance circulatoire.
La quatrième période a commencé par un changement d’humeur rapide et imprévu, caractérisé par une irritabilité et une agressivité frisant l’état maniaque, après quoi le patient est tombé dans le coma puis est décédé dans un intervalle de 2 heures. L’évolution clinique complète avait duré 35 heures depuis l’exposition jusqu’à la mort.
Les changements cliniques et pathologiques les plus marqués ont été observés au niveau des systèmes hématopoïétique et urinaire. Le sang circulant ne contenait plus de lymphocytes après la huitième heure et il y a eu un arrêt quasi complet de l’excrétion urinaire malgré l’administration d’importantes quantités de liquides.
La température rectale de K a varié entre 39,4 et 39,7 °C pendant les six premières heures, puis est retombée d’un seul coup à la normale, où elle s’est maintenue jusqu’à sa mort. Il a été considéré que la montée initiale de la température et son maintien à une valeur élevée pendant six heures cadraient avec une irradiation massive suspectée. Son pronostic avait été jugé très sérieux.
Parmi tous les résultats d’analyse obtenus durant l’évolution de la maladie, c’est la chute du nombre de globules blancs qui a été considérée comme un indicateur simple et fidèle d’une grave irradiation. La quasi-disparition des lymphocytes de la circulation périphérique six heures après l’exposition a été considérée comme un symptôme grave.
Seize agents thérapeutiques différents ont été utilisés pour le traitement symptomatique de K pendant une période de 30 heures. Malgré ces soins et l’administration constante d’oxygène, les battements de son cœur sont devenus faibles, lents et irréguliers près de 32 heures après l’irradiation; ils ont continué de s’affaiblir progressivement puis ont cessé 34 heures et 45 minutes après l’irradiation.
La tranche no 1 de Windscale correspondait à un réacteur à uranium naturel refroidi à l’air et modéré au graphite destiné à la production de plutonium. Le cœur a été partiellement détruit par un incendie le 15 octobre 1957. L’incendie a entraîné le rejet d’environ 0,74 PBq (10+15 Bq) d’iode 131I dans l’atmosphère, et sous le vent.
D’après le rapport d’information publié par la Commission de l’énergie atomique des Etats-Unis (US Atomic Energy Commission), l’accident a été causé par des erreurs de jugement des opérateurs au sujet des données fournies par des thermocouples, fautes qu’ont aggravées des erreurs de commande du réacteur qui ont permis que la température du graphite monte trop rapidement. Un facteur aggravant a été que les thermocouples devant mesurer la température du combustible avaient été placés dans la partie du réacteur qui s’échauffait le plus en fonctionnement normal (c’est-à-dire là où les débits de dose étaient les plus élevés) plutôt qu’aux endroits susceptibles d’être les plus chauds en cas d’anomalie. De plus, l’indicateur de puissance du réacteur, qui était étalonné pour un fonctionnement normal, a donné une lecture trop basse lors de la remontée de température. Par suite du deuxième cycle de chauffage, la température du graphite a monté le 9 octobre, surtout dans le bas de la partie frontale du réacteur, où des éléments de la gaine avaient cédé à cause de la hausse de température antérieure. De petites quantités d’iode ont été libérées le 9 octobre, mais qui n’ont été détectées que le 10 octobre lorsque l’indicateur d’activité de la cheminée a révélé une hausse sensible (laquelle n’a cependant pas été jugée importante). Enfin, dans l’après-midi du 10 octobre, un autre centre de contrôle (site de Calder) a signalé des fuites de radioactivité. Les efforts déployés pour refroidir le réacteur au moyen d’un courant d’air ont non seulement échoué, mais en fait accru l’importance de la radioactivité libérée dans l’atmosphère.
Les rejets produits par l’accident de Windscale sont estimés à 0,74 PBq d’iode (131I), 0,22 PBq de césium (137Cs), 3 TBq (1012 Bq) de strontium (89Sr) et 0,33 TBq de strontium (90Sr). A l’extérieur du site, le plus haut débit de dose absorbée de rayons gamma résultant de la radioactivité dans l’atmosphère était d’environ 35 µGy/h. Les mesures d’activité dans l’air autour des centrales de Windscale et de Calder ont souvent atteint cinq à dix fois la valeur maximale admissible, avec des pics occasionnels de 150. La consommation du lait produit dans un rayon d’environ 420 km a été interdite.
Au cours des opérations destinées à maîtriser le réacteur, 14 travailleurs ont reçu des équivalents de dose supérieurs à 30 mSv par trimestre civil, le maximum admissible étant de 46 mSv.
L’accident de Windscale a permis de tirer de nombreux enseignements sur la conception et l’exploitation des réacteurs à uranium naturel. Les lacunes notées dans l’instrumentation du réacteur et la formation des opérateurs ont également abouti à des constatations semblables à celles faites lors de l’accident de Three Mile Island (voir ci-après).
Il n’existait pas, avant l’accident, de lignes directrices concernant les normes à court terme de l’iode radioactif dans les aliments. Le Conseil de recherche médicale britannique (British Medical Research Council (BMRC)) a alors procédé à une étude aussi rapide que complète de la question et a fait preuve de beaucoup d’ingéniosité pour établir rapidement les concentrations admissibles d’iode131I dans les aliments. Le rapport intitulé Emergency Reference Levels , publié après l’accident, sert encore de base aujourd’hui, dans le monde entier, pour la rédaction de guides de planification d’urgence (Bryant, 1969).
Une relation utile a été établie pour prédire la contamination du lait par l’iode radioactif. On a découvert en effet que pour des niveaux de rayonnement gamma dépassant 0,3 µGy/h dans les pâturages, l’activité dans le lait produit dépassait 3,7 MBq/m3.
La dose absorbée par inhalation d’air contaminé à l’iode radioactif est négligeable par rapport à celle qui découle de l’ingestion de lait ou de laitages. En situation d’urgence, il vaut mieux recourir à la spectroscopie gamma, beaucoup plus rapide que l’analyse en laboratoire.
Après l’incident, 15 équipes de deux personnes ont procédé à des contrôles de rayonnement et prélevé des échantillons. Au total, 20 personnes se sont occupées de la coordination des échantillons et de la transmission des données. Près de 150 radiochimistes ont participé à l’analyse des échantillons.
Enfin, il est apparu que les filtres en laine de verre utilisés dans les cheminées ne sont pas satisfaisants en cas d’accident.
Les techniciens de la Gulf Oil Company se servaient d’un accélérateur Van de Graaff pour activer des échantillons de sol le 4 octobre 1967. La défaillance d’un dispositif d’interverrouillage de la commande de mise en marche de l’accélérateur, alors que plusieurs contacts d’interverrouillage de la porte du tunnel de sécurité et de la porte intérieure de la salle des cibles avaient été mis hors fonction à l’aide de ruban adhésif, a été à l’origine d’une grave irradiation accidentelle de trois personnes. La première a reçu environ 1 Gy d’équivalent de dose au corps entier, la deuxième près de 3 Gy et la troisième approximativement 6 Gy au corps entier, en sus d’environ 60 Gy aux mains et 30 Gy aux pieds.
L’une des victimes s’est présentée au service médical de l’établissement, se plaignant de nausées, de vomissements et de douleurs musculaires généralisées. Ces symptômes ont initialement été pris pour ceux de la grippe. Lorsque la deuxième victime s’est présentée au service médical avec plus ou moins les mêmes symptômes, on a soupçonné une importante irradiation, qu’ont confirmée les dosimètres personnels à film. Le docteur Niel Wald, de la division d’hygiène radiologique de l’Université de Pittsburgh, a supervisé la reconstitution dosimétrique et a aussi joué le rôle de médecin coordonnateur lors de l’examen et du traitement des patients.
Le docteur Wald a très rapidement fait venir par avion des unités de filtrage absolu au Western Pennsylvania Hospital de Pittsburgh où les trois victimes avaient été admises. Il a fait installer les filtres absolus à flux laminaire de façon à débarrasser l’environnement des patients de tout contaminant biologique. Le patient qui avait reçu 1 Gy est resté 16 jours en chambre stérile, tandis que les deux autres y ont séjourné près d’un mois et demi.
Le docteur E. Donnal Thomas, de l’Université de Washington, est venu huit jours après l’exposition pour pratiquer une greffe de moelle osseuse sur le patient qui avait reçu 6 Gy. La moelle avait été prélevée sur son frère jumeau. Si ces efforts remarquables ont permis de sauver la vie de la victime, ils n’ont pas suffi pour sauver ses bras et ses jambes, qui avaient reçu chacun une dose absorbée de plusieurs dizaines de grays.
Si la procédure d’exploitation très simple imposant l’usage d’un appareil de contrôle lorsqu’on entre dans un local exposé à des rayonnements avait été suivie, ce tragique accident aurait pu être évité. Au moins deux contacts d’interverrouillage avaient été bloqués au moyen de ruban adhésif longtemps avant l’accident. La mise hors fonction des dispositifs de protection, comme le prouve l’accident, est une pratique qui devrait être formellement interdite.
Les dispositifs d’interverrouillage de la commande de mise en marche de l’accélérateur auraient dû faire l’objet de contrôles réguliers dans le cadre de la maintenance.
Des soins rapides et judicieux ont permis de sauver la vie de la victime la plus exposée. La greffe totale de moelle osseuse, l’isolation en chambre stérile et des soins exceptionnels y ont largement contribué.
Des filtres absolus peuvent être obtenus en quelques heures pour être installés dans tout hôpital devant traiter des victimes d’irradiation.
Rétrospectivement, les médecins ont jugé qu’il aurait peut-être mieux valu recommander l’amputation plus tôt et, en tous cas, dans les deux à trois mois ayant suivi l’exposition. En effet, si l’amputation est effectuée plus tôt, les risques d’infection sont moindres, la période de grandes douleurs est raccourcie, ce qui réduit la quantité de médicaments à administrer pour combattre la douleur. Cela aurait permis d’écourter le séjour à l’hôpital de la victime et peut-être d’accélérer sa réadaptation. La décision d’amputer plus tôt doit bien sûr être prise après corrélation de l’information de dosimétrie et des observations cliniques.
Cet accident est le premier (et le seul) cas d’irradiation dans l’histoire de l’exploitation de réacteurs nucléaires aux Etats-Unis ayant entraîné la mort de personnes. Le SL-1 était un prototype d’un petit réacteur APPR (Army Package Power Reactor) conçu pour être transporté par avion à destination de zones isolées afin de produire du courant électrique. Le réacteur en cause servait à des essais de combustibles ainsi qu’à la formation des équipes chargées de faire fonctionner les réacteurs. Il était exploité dans un site désertique isolé de la station d’essais de réacteurs nucléaires d’Idaho Falls, dans l’Idaho, par la société Combustion Engineering, pour le compte de l’armée américaine. Le SL-1 n’était pas un réacteur nucléaire commercial (United States Atomic Energy Commission (USAEC), 1961; ANS, 1961).
Au moment de l’accident, le SL-1 était muni de 40 éléments combustibles et de 5 barres de commande. Il pouvait générer 3 MW de puissance thermique. Il s’agissait d’un réacteur refroidi et modéré à l’eau bouillante.
L’accident a occasionné la mort de trois militaires. Il a été causé par un retrait de plus de 1 m d’une seule barre de commande. Ce retrait a provoqué un état de criticité instantanée dans le réacteur. On ne sait pas pourquoi un opérateur agréé et compétent ayant une assez longue expérience des opérations de chargement du combustible a retiré une barre de commande au-delà de son point d’arrêt.
L’un des trois militaires était encore vivant lorsque les premiers secours sont arrivés sur les lieux. Des produits de fission à haute activité couvraient son corps et étaient incrustés dans sa peau. Certaines zones de celle-ci donnaient des lectures dépassant 4,4 Gy/h à 15 cm, ce qui a retardé le sauvetage et les premiers soins.
Aucun réacteur construit depuis l’accident du SL-1 ne peut atteindre un état de criticité instantanée par suite du retrait d’une seule barre de commande.
Sur les sites de tous les réacteurs, il doit y avoir des appareils de contrôle portables ayant un intervalle de mesure supérieur à 20 mGy/h. En fait, des appareils ayant une gamme supérieure allant jusqu’à 10 Gy/h sont recommandés.
Note: l’accident de Three Mile Island a montré que la gamme de mesure requise pour les rayonnements bêta et gamma est de 100 Gy/h.
Il est nécessaire de disposer d’installations de traitement où un patient fortement contaminé peut recevoir un traitement médical non provisoire sans que le personnel soignant soit exposé à des risques inutiles. Comme la plupart de ces installations se trouveront nécessairement dans des établissements hospitaliers ayant à assurer d’autres services, il faudra sans doute prendre des mesures spéciales pour garantir une protection adéquate contre les contaminants radioactifs présents dans l’air et dans l’eau.
Les expositions accidentelles aux rayons X sont nombreuses et consistent souvent en irradiations extrêmement fortes sur de petites parties du corps. Il n’est pas rare que des systèmes à diffraction de rayons X produisent des débits de dose absorbée de 5 Gy/s à 10 cm du foyer du tube. A de plus petites distances, on a souvent mesuré des débits de 100 Gy/s. Le faisceau est ordinairement étroit, mais une exposition de quelques secondes suffit pour causer de graves lésions locales (Lubenau et coll., 1967; Lindell, 1968; Haynie et Olsher, 1981; ANSI, 1988).
C’est lorsque ces systèmes sont employés dans des circonstances «inhabituelles» qu’ils risquent de causer des expositions accidentelles. Les installations de radiographie utilisées dans des conditions normales de fonctionnement semblent raisonnablement sûres et les défaillances du matériel ont rarement causé de graves irradiations.
La plupart des expositions accidentelles aux rayons X se sont produites dans des conditions inhabituelles, le plus souvent à un moment où l’appareil était partiellement démonté ou dépourvu de sa gaine de protection.
Dans la plupart des cas d’exposition grave, le personnel d’exploitation et d’entretien n’avait pas reçu une formation suffisante.
Si l’on avait eu recours à des méthodes simples, mais fiables, pour garantir que l’alimentation du tube à rayons X est bien coupée lors de travaux de réparation ou de maintenance, bien des expositions accidentelles auraient pu être évitées.
Les opérateurs et le personnel d’entretien travaillant sur ces appareils devraient porter des dosimètres personnels au doigt ou au poignet.
Si des sécurités avaient été prescrites de manière obligatoire, de nombreux accidents ne se seraient pas produits.
Une erreur de l’opérateur a été l’un des facteurs de la plupart des accidents. L’absence d’enveloppe adéquate ou une mauvaise conception de la gaine protectrice ont souvent aggravé la situation.
Entre les années cinquante et les années soixante-dix, ce sont les opérations de radiographie industrielle qui ont causé le taux le plus élevé d’accidents par irradiation pour une activité unique (AIEA, 1969, 1977). Les organismes de réglementation nationaux poursuivent leurs efforts pour réduire ce taux en améliorant les règlements, en imposant des exigences plus strictes de formation et en appliquant des politiques d’inspection et de surveillance encore plus sévères (United States Code of Federal Regulations (USCFR), 1990). Ces efforts ont généralement réussi, mais le nombre d’accidents de radiographie industrielle demeure élevé. Des dispositions législatives permettant d’imposer d’énormes amendes pourraient constituer le moyen le plus efficace d’attirer l’attention des cadres du secteur de la radiographie industrielle (et, du même coup, celle des travailleurs) sur la radioprotection.
Formation des travailleurs . C’est dans le domaine de la radiographie industrielle que les exigences en matière d’études et de formation concernant les rayonnements ionisants sont les moins rigoureuses. Il est donc d’autant plus important d’exiger une application stricte des règles de formation existantes.
Rémunération au rendement . Depuis des années, on donne une grande importance dans le secteur de la radiographie industrielle au nombre de clichés réussis produits par jour. Cette pratique peut entraîner des manquements sérieux aux règles de sécurité et, occasionnellement, inciter certains radiographes à ne pas porter leur dosimètre si bien que les dépassements des limites admissibles d’équivalents de dose ne sont pas détectés.
Contrôle de l’équipement . Il est extrêmement important de contrôler soigneusement les sources de radiographie industrielle (voir figure 48.24) après chaque cliché. L’omission de ces contrôles est la cause la plus probable d’expositions accidentelles, dont beaucoup ne sont pas déclarées puisque les techniciens de radiographies industrielles portent rarement des dosimètres à la main ou au doigt (voir figure 48.24).
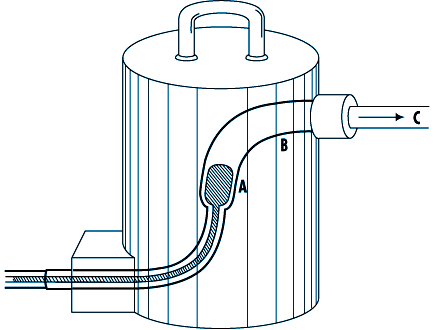
Défaillances de l’équipement . Par suite d’une utilisation intensive des projecteurs de radiographie industrielle, les mécanismes de rétraction de la source peuvent prendre du jeu et la source ne pas rentrer complètement dans son logement (point A de la figure 48.24). De nombreux cas de défaillance des sécurités armoire-source provoquent également des expositions accidentelles du personnel.
Il existe d’excellents guides, tant généraux que spécialisés, pour la conception de plans d’urgence. Nous en énumérons quelques-uns dans les références complémentaires figurant à la fin du chapitre.
On commence par évaluer l’ensemble des stocks de matières radioactives de l’installation en cause. On analyse ensuite les accidents vraisemblables pour déterminer les fuites maximales probables de radioactivité. Enfin, on élabore un plan et des procédures d’application permettant aux exploitants de l’installation:
Nous présentons ci-dessous, par ordre de probabilité décroissant, une liste des types d’accidents pouvant survenir dans le cas d’un réacteur nucléaire (les accidents industriels de type général non nucléaire, cependant, sont de loin les plus probables):
La figure 48.25 présente la table des matières d’un modèle de plan d’urgence de centrale nucléaire. Tout plan d’urgence doit comporter chacun des chapitres représentés et tous les éléments supplémentaires nécessaires pour répondre aux besoins locaux. La figure 48.26 présente en outre une liste des procédures courantes de mise en œuvre pour un réacteur de puissance.
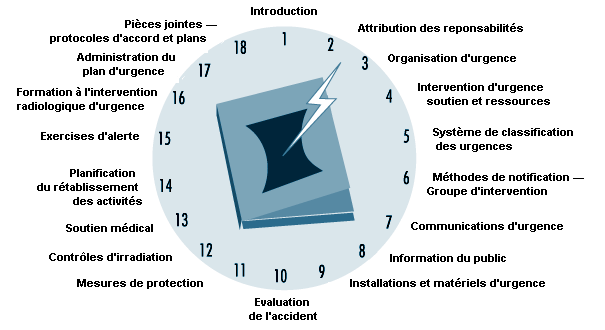
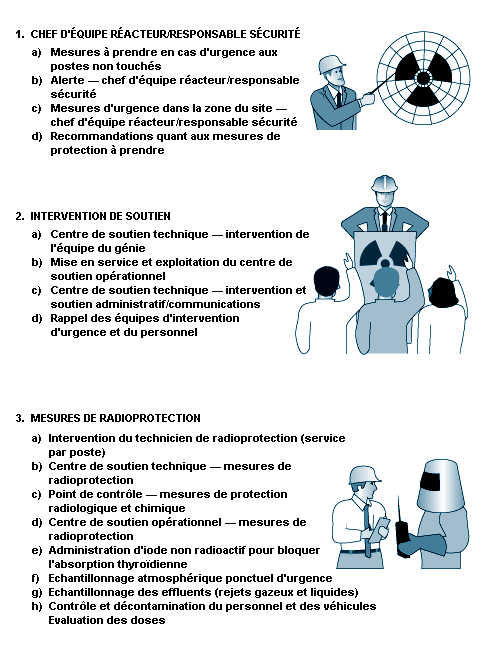
Dans les grandes installations, il existe ordinairement des plans d’urgence de surveillance radiologique de l’environnement (souvent désignés aux Etats-Unis par le sigle EREMP (Emergency Radiological Environmental Monitoring Programme)).
L’une des plus importantes leçons que la Commission américaine de réglementation nucléaire (Nuclear Regulatory Commission (NRC)) et d’autres organismes officiels des Etats-Unis aient tirées de l’accident de Three Mile Island est qu’il est impossible d’appliquer un programme de surveillance environnementale en un ou deux jours s’il n’y a pas eu de planification préalable de grande ampleur. Malgré les millions de dollars consacrés par le gouvernement américain à la surveillance de l’environnement aux alentours de la centrale nucléaire de Three Mile Island après l’accident, moins de 5% des rejets totaux ont été mesurés. Ce résultat témoigne d’une planification préalable insuffisante et inadaptée.
L’expérience a prouvé que, pour être efficace, un tel programme doit faire partie de l’effort régulier de surveillance radiologique de l’environnement. Durant les premiers jours de l’accident de Three Mile Island, les responsables de la centrale se sont rapidement rendu compte qu’il est impossible de mettre sur pied en un ou deux jours un programme efficace de surveillance d’urgence, quelle que soit l’importance des effectifs et des fonds qui y sont consacrés.
Tous les points d’échantillonnage employés dans le cadre d’un programme régulier de surveillance environnementale sont utilisés en cas de surveillance à long terme après un accident. Il faut en outre y ajouter un certain nombre de nouveaux points pour que les équipes de surveillance motorisées aient des lieux de prélèvement dans chaque segment de chaque secteur de 22,5° de la zone entourant la centrale (voir figure 48.27). En général, les points de prélèvement se trouveront dans des zones accessibles par la route. Cependant, il peut y avoir des exceptions à cette règle dans le cas de sites normalement inaccessibles par la route, mais qui peuvent cependant être occupés occasionnellement, comme les terrains de camping et les sentiers de randonnée pédestre se trouvant dans un rayon de 16 km à partir de la centrale dans le sens du vent.
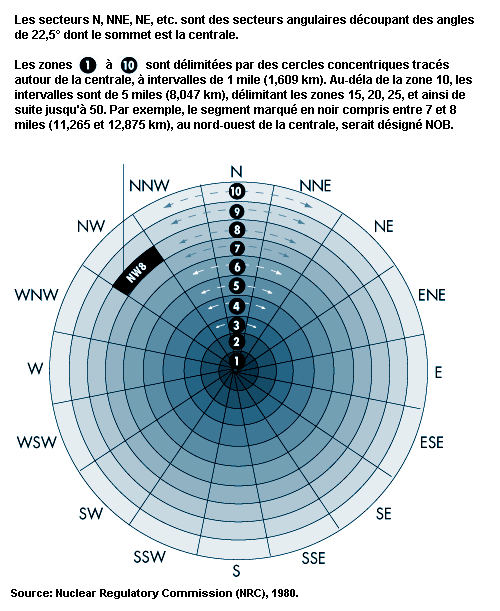
La figure 48.27 montre comment sont désignés les secteurs et les segments où se trouvent les points de surveillance radiologique autour de la centrale. On peut désigner les secteurs de 22,5° par les directions des points cardinaux et collatéraux (par exemple, N, NNE et NE) ou par des lettres dans l’ordre alphabétique (par exemple, de A à R). L’utilisation de ces dernières n’est cependant pas recommandée parce qu’il est facile de les confondre avec les désignations des points cardinaux. Ainsi, il est moins ambigu, pour désigner l’ouest, d’utiliser O ou W plutôt que N.
Il conviendrait de visiter chaque point de prélèvement désigné dans le cadre d’exercices sur le terrain pour que les responsables de la surveillance et du prélèvement apprennent à connaître les lieux et les problèmes éventuels: zones de silence radio, mauvaises routes, difficultés d’accès dans l’obscurité, etc. Comme il est impossible d’organiser un exercice couvrant en une fois tous les points désignés de la zone de 16 km de rayon, il faudrait prévoir un programme d’exercices permettant de visiter tour à tour les différents points. Il est souvent utile de déterminer d’avance si les véhicules des équipes de surveillance peuvent communiquer avec chacun des points désignés d’échantillonnage. L’emplacement précis de ces points est choisi en fonction des mêmes critères que pour le programme régulier de surveillance radiologique de l’environnement (Nuclear Regulatory Commission (NRC), 1980): visibilité directe, zone morte minimale, habitants, agglomération et établissements (école, hôpital, maison de retraite, élevage laitier, exploitation maraîchère, exploitation agricole, etc. les plus proches).
Lors d’un accident ayant provoqué la libération d’importantes quantités de matières radioactives, des équipes de surveillance radiologique devraient constamment parcourir les environs et, si les circonstances le permettent, les lieux mêmes de l’accident. Ces équipes devraient ordinairement mesurer le niveau ambiant de rayonnement gamma et bêta et prendre des échantillons d’air pour y détecter la présence de poussières et d’éléments halogènes radioactifs.
Ces équipes doivent bien connaître toutes les procédures de surveillance, y compris le contrôle de leur propre exposition, et être en mesure de transmettre les données recueillies à leur station de base. Des détails tels que le genre d’appareil de mesure, le numéro de série et l’état ouvert ou fermé de la fenêtre doivent être soigneusement notés sur des feuilles de contrôle conçues avec soin.
S’il y a urgence, l’équipe de surveillance d’urgence peut avoir à opérer pendant 12 heures d’affilée. Après la période initiale, cependant, le temps passé sur le terrain devrait être ramené à 8 heures par jour, avec au moins une pause de 30 minutes.
Comme il est possible que l’on ait à assurer une surveillance permanente, il faudrait prendre des dispositions préalables pour pouvoir, le moment venu, ravitailler les équipes en aliments, boissons, appareils de remplacement et piles et pour apporter et remporter les filtres à air.
Même si les équipes de surveillance ont à faire un service continu de 12 heures d’affilée, il faut prévoir trois équipes par jour pour assurer une surveillance permanente. Dans les deux premières semaines qui ont suivi l’accident de Three Mile Island, il y a eu constamment sur le terrain un minimum de cinq équipes de surveillance. Le soutien logistique d’un tel effort nécessite une planification préalable soigneuse.
Les types d’échantillons environnementaux prélevés lors d’un accident dépendent des types de rejets (atmosphériques ou dans l’eau), de la direction du vent et de la saison. On doit prélever des échantillons de sol et d’eau potable en toute saison, y compris l’hiver. Même si l’on n’a pas décelé d’éléments halogènes radioactifs dans l’atmosphère, on devra prélever des échantillons de lait à cause de l’importance de la bioaccumulation.
Il est important de prélever de nombreux échantillons d’aliments et d’air pour pouvoir rassurer le public, même sans justification technique sérieuse. De plus, les données ainsi prélevées pourraient être très utiles en cas d’actions judiciaires ultérieures.
L’utilisation de feuilles de contrôle établies d’avance et remplies en conformité avec des procédures soigneusement élaborées de collecte de données est essentielle pour l’échantillonnage de l’environnement. Toutes les personnes devant prélever des échantillons doivent avoir fait la preuve qu’elles comprennent bien les procédures et pouvoir prouver qu’elles ont reçu une formation suffisante sur le terrain.
Si possible, la collecte de prélèvements environnementaux hors site devrait être confiée à un groupe extérieur indépendant. Il est préférable que le même groupe se charge également du prélèvement d’échantillons réguliers, afin que l’équipe interne expérimentée puisse être affectée à d’autres travaux de collecte de données au cours d’un accident.
Il convient de signaler que, lors de l’accident de Three Mile Island, chaque échantillon qui devait être prélevé l’a effectivement été et que pas un seul de ces échantillons n’a été perdu. Ce fait est d’autant plus remarquable que le taux d’échantillonnage avait plus que décuplé par rapport à son niveau d’avant l’accident.
Il faudrait pouvoir disposer, en cas d’urgence, d’un stock d’équipement de surveillance double par rapport à celui qui est normalement nécessaire. Cet équipement devrait être rangé dans des placards disséminés un peu partout aux alentours de chaque complexe nucléaire, afin qu’un même accident ne puisse condamner l’accès à tous les placards en même temps. Pour que l’équipement soit toujours prêt, il faudrait l’inventorier et l’étalonner au moins deux fois par an et après chaque exercice. Les fourgonnettes et les camions des grandes installations nucléaires devraient être complètement équipés pour la surveillance d’urgence tant à l’extérieur qu’à l’intérieur du complexe.
Une situation d’urgence risque de rendre inutilisables les laboratoires de comptage internes de la centrale ou de l’installation. Il faut donc prévoir d’avance la possibilité de recours à un autre établissement ou à un laboratoire mobile. C’est là une exigence à laquelle doivent se conformer toutes les centrales nucléaires des Etats-Unis (NRC, 1983).
Le type et le degré de perfectionnement de l’équipement de surveillance de l’environnement devraient être adaptés aux conditions correspondant à l’accident le plus grave vraisemblable pouvant être subi par l’installation nucléaire en cause. La liste ci-après énumère le matériel de surveillance de l’environnement dont on a en général besoin dans une centrale nucléaire.
En cas d’accident grave, l’analyse des données environnementales devrait être transférée le plus tôt possible à l’extérieur des lieux, par exemple au centre extérieur pour les opérations d’urgence.
Des lignes directrices devraient être établies d’avance pour préciser quand les données tirées des échantillons autour du site doivent être transmises à la direction. Il faudrait également convenir, dans les premières heures suivant un accident, de la méthode et de la fréquence de transmission de ces données aux organismes gouvernementaux compétents.
Il a fallu recourir à des consultants extérieurs pour assumer les tâches suivantes, parce que les spécialistes internes en radioprotection étaient trop occupés par d’autres fonctions durant les premières heures de l’accident survenu le 28 mars 1979 à Three Mile Island:
Aux alentours du 13 septembre 1985, un appareil de téléthérapie comportant une source de césium 137Cs de 51 TBq est volé dans une clinique abandonnée de Goiânia, au Brésil. Deux personnes cherchant de la ferraille ramènent chez elles la tête de l’appareil et tentent d’en démonter les pièces, sans connaître le sens du symbole «trèfle» figurant sur l’enveloppe de la source. Le débit de dose absorbée provenant de la tête d’irradiation est d’environ 46 Gy/h à 1 m.
L’enveloppe de la source se casse au cours du démontage, libérant une importante quantité de poudre hautement soluble de chlorure de césium 137 (137CsCl), qui est disséminée dans une partie de cette ville de 1 million d’habitants, causant l’un des plus graves accidents liés aux sources scellées de l’histoire.
Après le démontage, ce qui reste de la tête de la source est vendu à un marchand de ferraille, qui découvre que la poudre de 137CsCl émet une lueur bleuâtre dans l’obscurité (probablement par suite du rayonnement Mallet-Cerenkov). Celui-ci croit alors que la poudre provient d’une pierre précieuse ou même qu’elle a des propriétés surnaturelles. De nombreux amis et parents viennent voir la poudre «magique». Des parties de la source sont distribuées à un certain nombre de familles, le processus se poursuivant pendant environ cinq jours. A l’issue de cette période, un certain nombre de personnes présentent des symptômes du syndrome gastro-intestinal par suite de l’exposition au rayonnement.
Les victimes qui se rendent à l’hôpital à cause de leurs graves troubles gastro-intestinaux se font dire au départ qu’il s’agit de réactions allergiques d’origine alimentaire. Les médecins croient même que l’une d’elles, qui présente des effets cutanés sévères parce qu’elle a manipulé la source, souffre d’une maladie de peau et l’envoient à l’hôpital des maladies tropicales.
Cette succession tragique d’événements se poursuit sans qu’aucun spécialiste ne soupçonne la vérité pendant près de deux semaines. De nombreuses personnes s’amusent à se frotter avec la poudre de 137CsCl pour que leur peau émette de la lumière bleue dans l’obscurité. La tragédie aurait pu se poursuivre longtemps si l’une des personnes irradiées n’avait pas finalement fait le lien entre ces symptômes et la source d’irradiation. Elle prend donc les restes de la source de 137CsCl et va en autobus la remettre au service d’hygiène publique de Goiânia. Le lendemain, un biophysicien en visite examine la source et, de sa propre initiative, décide de faire évacuer deux parcs à ferraille contaminés et d’avertir les autorités. Il convient de souligner qu’une fois mis au courant de l’accident, le gouvernement brésilien a agi avec célérité et de manière très organisée.
Au total, 249 personnes ont été contaminées et 54 ont été hospitalisées à cause de cet accident. Celui-ci a fait 4 morts dont une fillette de six ans qui avait reçu une dose interne d’environ 4 Gy après avoir ingéré près de 1 GBq (109 Bq) de 137CsCl.
Dans sa phase initiale, l’intervention visait les objectifs suivants:
Les premières mesures prises par l’équipe médicale ont été:
L’action des spécialistes en radioprotection a consisté:
Quatre victimes sont mortes après avoir reçu des doses allant de 4 à 6 Gy. Deux autres, qui manifestaient de graves symptômes d’aplasie médullaire ont survécu en dépit du fait qu’elles avaient reçu des doses absorbées de 6,2 et 7,1 Gy (estimation obtenue par dosimétrie biologique). Quatre autres patients ont survécu à des doses absorbées estimées entre 2,5 et 4 Gy.
Dix-neuf des 20 patients hospitalisés présentaient des lésions cutanées radio-induites, qui avaient commencé sous forme d’œdème et de phlyctène; ces lésions ont évolué en épidermite sèche, puis exsudative. Dix des 19 personnes atteintes avaient des lésions profondes quatre à cinq semaines après l’irradiation. Ces lésions témoignent d’une importante exposition gamma des tissus profonds.
Toutes les lésions cutanées étaient contaminées au 137Cs, avec des débits de dose absorbée atteignant 15 mGy/h.
La fillette de six ans qui avait ingéré 1 TBq de 137Cs (et qui en est morte un mois plus tard) présentait une contamination générale de la peau avec une moyenne de 3 mGy/h.
L’un des patients a dû être amputé un mois après l’irradiation. Dans ce cas, une artériographie a été utile pour faire la démarcation entre les artérioles saines et celles qui étaient atteintes.
Les analyses statistiques n’ont révélé aucune différence significative entre les charges corporelles déterminées par anthropogammamétrie et celles qui étaient basées sur les analyses d’urine.
Il a été possible de valider des modèles établissant des relations entre les données d’analyse, d’une part, et l’incorporation et les charges corporelles, de l’autre. Ces modèles s’appliquaient aussi à des groupes d’âge différents.
L’administration de bleu de Prusse a permis de favoriser l’élimination du 137CsCl (quand le débit de dose dépassait 3 Gy/jour).
Dix-sept patients ont reçu des diurétiques pour favoriser l’élimination de leur charge corporelle de 137CsCl. Ce traitement a été interrompu parce qu’il s’est révélé inefficace.
Tous les patients ont été soumis à une décontamination de la peau à l’aide d’eau savonneuse, d’acide acétique et de bioxyde de titane (TiO2). L’opération n’a que partiellement réussi. On a soupçonné la transpiration de recontaminer la peau par exsudation d’une partie de la charge corporelle de 137Cs.
Les lésions cutanées contaminées sont très difficiles à nettoyer. La perte des tissus cutanés nécrosés a, cependant, sensiblement réduit le niveau de contamination.
La fréquence des aberrations chromosomiques lymphocytaires mesurée à différents moments après l’accident a évolué selon trois schémas différents:
Dans deux cas, la fréquence des aberrations est restée constante jusqu’à un mois après l’accident, puis est tombée à 30% de la fréquence initiale trois mois plus tard.
Dans deux autres cas, on a observé une diminution progressive d’environ 20% tous les trois mois.
Dans deux des cas de contamination interne particulièrement grave, on a noté des augmentations de la fréquence des aberrations (d’environ 50 et 100%) au cours d’une période de trois mois.
L’évacuation des logements a été recommandée si les taux de dose absorbée dépassaient 10 µGy/h à 1 m de hauteur à l’intérieur du logement.
Pour la décontamination des locaux, des vêtements, du sol et des aliments, le critère était que la dose absorbée par une personne ne devait pas dépasser 5 mGy en un an. L’application de ce critère à différentes voies d’exposition a abouti aux résultats suivants: on décontaminait l’intérieur d’une maison si la dose absorbée pouvait dépasser 1 mGy en un an et on décontaminait le sol si la dose absorbée pouvait dépasser 4 mGy en un an (3 mGy d’irradiation externe et 1 mGy d’exposition interne).
Le pire accident nucléaire au monde s’est produit le 26 avril 1986 pendant l’exécution d’un essai technique à très faible puissance électrique. Pour effectuer l’essai, on avait arrêté ou bloqué plusieurs systèmes de sécurité.
Le réacteur en cause était un RBMK-1000, modèle qui servait à produire près de 65% de toute l’énergie électrique d’origine nucléaire générée en Union soviétique. Il s’agissait d’un réacteur à eau bouillante modéré au graphite d’une puissance de 1 000 MWe. Le RBMK-1000, qui n’a pas d’enceinte de confinement résistant à la pression, diffère des types couramment construits dans la plupart des autres pays.
Le réacteur est passé instantanément à un état de criticité et il en est résulté une série d’explosions dans le circuit vapeur. Ces explosions ont fait sauter tout le sommet du réacteur, détruisant la mince enveloppe qui le recouvrait et déclenchant une série d’incendies sur le toit en asphalte épais des réacteurs 3 et 4. Les rejets radioactifs ont duré dix jours. Au total l’accident a tué 31 personnes. La délégation soviétique à l’Agence internationale de l’énergie atomique (AIEA) a présenté un rapport sur l’accident. Il a été déclaré que les expériences qui avaient provoqué l’accident du réacteur 4 de Tchernobyl n’avaient pas reçu l’autorisation requise et que les règles écrites concernant les mesures de sécurité dans l’exploitation du réacteur étaient insuffisantes. On a ajouté que «le personnel en cause n’avait pas été préparé de manière satisfaisante pour effectuer les essais en question et n’était pas conscient des risques qu’ils comportaient». La série d’essais effectuée a créé des conditions dangereuses qui ont abouti à un accident, dont presque personne ne croyait à la possibilité.
En gros, près de 1 900 PBq de produits de fission et de combustible (collectivement désignés sous le terme corium par l’équipe qui était chargée de la remise en état de Three Mile Island) ont été libérés pendant les dix jours qu’il a fallu aux autorités pour éteindre tous les incendies et sceller la tranche 4 à l’aide d’un écran protecteur absorbant les neutrons. La tranche 4 est aujourd’hui murée dans un sarcophage d’acier et de béton, qui contient le corium résiduel entourant les restes du cœur détruit.
Vingt-cinq pour cent des 1 900 PBq ont été libérés dans la journée qui a suivi l’accident et le reste pendant les neuf jours suivants.
Les rejets les plus significatifs du point de vue radiologique comprenaient 270 PBq de 131I, 8,1 PBq de 90Sr et 37 PBq de 137Cs. Signalons, aux fins de comparaison, que l’accident de Three Mile Island avait libéré 7,4 TBq de 131I et des quantités indécelables de 90Sr et de 137Cs.
Les premiers rejets ont été emportés par le vent dans une direction généralement orientée vers le nord, mais par la suite, le vent a tourné et soufflé les rejets vers l’ouest et le sud-ouest. Le premier panache radioactif a atteint la Suède et la Finlande le 27 avril. Les programmes de surveillance radiologique de l’environnement des centrales nucléaires ont immédiatement permis de détecter les rejets et d’alerter le monde au sujet de l’accident. Une partie du premier panache a dérivé vers la Pologne et l’Allemagne de l’Est. Les panaches suivants sont arrivés sur l’Europe de l’Est et l’Europe centrale les 29 et 30 avril. Par la suite, le Royaume-Uni a pu détecter les rejets de Tchernobyl le 2 mai, suivi par le Japon et la Chine le 4 mai, l’Inde le 5 mai, puis le Canada et les Etats-Unis les 5 et 6 mai. Le panache n’a pas été signalé dans l’hémisphère sud.
Les retombées dues aux panaches dépendaient surtout des précipitations. Les schémas de retombée des principaux radionucléides (131I, 137Cs,134Cs et 90Sr) étaient très variables, même à l’intérieur de l’Union soviétique. Les plus grands risques découlaient de l’irradiation externe due à la contamination de surface et de l’irradiation interne par ingestion d’aliments contaminés.
Deux personnes sont décédées immédiatement, une dans l’effondrement du bâtiment et l’autre, 5 heures et demie plus tard, de brûlures thermiques. Par la suite, 28 autres membres du personnel du réacteur et de l’équipe de sapeurs-pompiers sont morts de lésions dues à l’irradiation. Quant aux doses reçues par la population des alentours, elles étaient inférieures aux niveaux pouvant causer des effets d’irradiation immédiats.
L’accident de Tchernobyl a presque doublé (de 32 à 61) le nombre total de décès survenus dans le monde jusqu’en 1986 par suite d’accidents dus aux rayonnements (il est intéressant de noter que les trois morts de l’accident du réacteur SL-1 aux Etats-Unis sont officiellement imputés à l’explosion de canalisations de vapeur et que les deux premiers décès à Tchernobyl ne sont pas non plus attribués aux rayonnements).
Les membres du personnel qui se trouvaient sur place et qui couraient les plus grands risques ne disposaient pas de dosimètres individuels. L’absence de nausées et de vomissements dans les six premières heures qui ont suivi l’irradiation était un signe fiable indiquant que la dose absorbée n’était probablement pas fatale. C’est ainsi que l’on a pu reconnaître les patients qui n’avaient pas besoin d’un traitement immédiat pour leur irradiation. Cette information, ainsi que les résultats des analyses sanguines (diminution de la numération lymphocytaire) ont été plus utiles que les données de dosimétrie du personnel.
Les tenues de protection des sapeurs-pompiers (en toile épaisse, mais poreuse) ont permis aux produits de fission à haute activité spécifique d’attaquer l’épiderme. Ces doses de rayonnement bêta ont causé des brûlures graves qui ont joué un rôle important dans beaucoup des décès survenus. Cinquante-six travailleurs ont ainsi été gravement brûlés. Ces brûlures étaient extrêmement difficiles à traiter et constituaient une grave complication parce qu’elles empêchaient les sauveteurs de décontaminer les patients avant de les transporter à l’hôpital.
Il n’y avait pas à ce moment de charges corporelles cliniquement significatives. Seules deux personnes avaient des charges corporelles élevées (mais non cliniquement significatives).
Sur le millier de personnes examinées, 115 ont été hospitalisées pour syndrome d’exposition aiguë. Huit membres du personnel médical qui travaillait sur place ont souffert du syndrome.
Comme on pouvait s’y attendre, les analyses n’ont pas révélé d’exposition aux neutrons (ces analyses se basent sur la recherche de sodium 24Na dans le sang).
Les mesures prises pour protéger le public se répartissent entre quatre périodes distinctes.
Enfin, de grands efforts ont été déployés pour décontaminer les régions environnantes.
D’après le Comité scientifique des Nations Unies pour l’étude des effets des rayonnements ionisants (UNSCEAR), la dose radiologique totale reçue par la population de l’Union soviétique s’élève à 226 000 personnes-Sv (72 000 personnes-Sv engagées durant la première année). Pour le monde entier, on estime l’équivalent de dose collectif à environ 600 000 personnes-Sv. Avec le temps et de nouvelles études, il sera possible de préciser ce chiffre (UNSCEAR, 1988).
|
Agence internationale de l’énergie atomique (AIEA) Commission internationale des unités et mesures radiologiques Commission internationale de protection radiologique (CIPR) Association internationale pour la protection Comité scientifique des Nations Unies pour l’étude des effets |